Majalah Farmasetika, 10 (5) 2025, 400-413
https://doi.org/10.24198/mfarmasetika.v10i5.66711
Artikel Penelitian
Ananda Putri Aulia Mulyadi1*, Aliya Nur Hasanah2, Felix Chandra3
1Program Studi Profesi Apoteker, Fakultas Farmasi, Universitas Padjadjaran, Jatinangor
45363
2Departemen Analisis Farmasi dan Kimia Medisinal, Fakultas Farmasi, Universitas
Padjadjaran, Jatinangor 45363
3PT Menarini Indria Laboratories, Kabupaten Bekasi, Jawa Barat 17530
*E-mail : ananda21010@mail.unpad.ac.id
(Submit 11/09/2025, Revisi 18/09/2025, Diterima 20/09/2025, Terbit 28/09/2025)
Abstrak
Penimbangan menjadi tahap awal dalam proses pembuatan obat dan secara langsung memengaruhi mutu produk akhir. Industri farmasi umumnya menerapkan penimbangan “fresh” untuk menjaga stabilitas material, yaitu penimbangan yang dilakukan sesaat sebelum digunakan dengan batas waktu tertentu. Namun, penerapan penimbangan “fresh” menimbulkan inefisiensi dalam alur produksi dan membatasi fleksibilitas perencanaan produksi. Penelitian ini bertujuan untuk menilai risiko perubahan proses penimbangan dari sistem “fresh” menjadi penimbangan dalam satu waktu pada industri X menggunakan metode Failure Mode and Effect Analysis (FMEA). Hasil pengkajian mengidentifikasi tiga risiko kategori sedang pada tahap penyimpanan material hasil timbang berdasarkan nilai Risk Priority Number (RPN). Mitigasi yang diusulkan adalah revisi daftar masa simpan material hasil timbang sesuai disposisi hasil kajian dan studi batas masa simpan material setelah penimbangan dengan prioritas pada material tertentu. Langkah mitigasi tersebut bertujuan untuk menurunkan risiko mutu akibat perubahan proses penimbangan, meningkatkan jaminan kualitas berbasis data ilmiah, dan mendukung kepatuhan Standar Cara Pembuatan Obat yang Baik (CPOB).
Kata kunci: FMEA, Penilaian Risiko, Penimbangan “Fresh”
Teks Lengkap:
Pendahuluan
Pendahuluan
Industri farmasi sebagai produsen produk obat memiliki kewajiban mendasar untuk menjaga kualitas produk selama siklus hidup produk obat tersebut. Siklus hidup produk obat pada proses manufaktur dimulai dari pengadaan dan rantai pasok; penyimpanan dan pengendalian material; dilanjutkan dengan proses produksi seperti penimbangan material, pencampuran, pengisian, pemeriksaan, pelabelan, pengemasan, penyimpanan, distribusi, hingga produk obat mencapai tanggal kedaluwarsa (1). Pembuatan obat di industri farmasi ini mengacu pada Standar Cara Pembuatan Obat yang Baik (CPOB) yang mengatur agar obat yang diproduksi sesuai dengan standar kualitas, keamanan, dan efikasi (2).
Dalam proses pembuatan obat, salah satu tahapan yang perlu diperhatikan adalah penimbangan yang menjadi tahapan awal dalam proses pembuatan obat dan secara langsung memengaruhi mutu produk akhir (3). Penimbangan (dispensing) adalah kegiatan menghitung dan menimbang semua material yang diperlukan sesuai formulasi produk, kemudian menyerahkan material tersebut untuk digunakan dalam produksi (4). Material yang telah ditimbang sering kali tidak langsung digunakan dalam tahapan proses produksi berikutnya. Material tersebut memiliki sifat stabilitas yang berbeda-beda, terdapat beberapa material yang rentan menguap, higroskopis, serta sensitif terhadap cahaya, pH, atau suhu (5). Hal ini dapat menimbulkan risiko material terdegradasi karena material tersebut telah dibuka dari kemasan primernya. Oleh karena itu, untuk menjaga stabilitas dan menghindari risiko material terdegradasi, maka material tersebut membutuhkan kondisi penyimpanan yang sesuai (6).
Untuk mengatasi isu stabilitas dari material hasil penimbangan tersebut, industri farmasi umumnya menerapkan proses penimbangan “fresh”. Penimbangan “fresh” adalah proses penimbangan yang dilakukan sesaat sebelum digunakan dengan batas waktu tertentu. Selain itu, penimbangan “fresh” termasuk ke dalam konsep lean manufacturing yang menekankan pada sistem operasi yang sederhana dan efisien yang mampu menggunakan secara optimal sumber daya di industri (7). Industri X menerapkan ketentuan proses penimbangan “fresh” maksimal 24 jam berdasarkan hasil studi waktu penyimpanan material setelah ditimbang yang mengindikasikan potensi penurunan kualitas atau stabilitas material setelah periode tersebut.
Namun, penerapan proses penimbangan “fresh” dalam operasional aktual industri X tersebut menunjukkan beberapa hambatan. Sebagian besar material tersebut belum dilakukan studi masa simpan setelah penimbangan dan sebagian kecilnya sudah dilakukan studi masa simpan setelah penimbangan, tetapi hasilnya tidak memenuhi syarat pada hari ke-14. Oleh karena itu, batas 24 jam tersebut lebih bersifat preventif daripada berbasis data ilmiah. Di samping itu, proses penimbangan “fresh” ini menimbulkan inefisiensi dalam alur produksi karena mengharuskan penjadwalan penimbangan dilakukan dalam batas waktu 24 jam sebelum proses pencampuran. Hal ini membatasi fleksibilitas perencanaan produksi karena waktu mulai dan akhir unit hilir harus disinkronkan dengan unit hulu. Jika terjadi kendala pada proses penimbangan, maka dapat berpotensi menyebabkan penundaan produksi (8).
Selain itu, proses penimbangan “fresh” dinilai inefisiensi terhadap material yang diketahui stabil dalam kondisi penyimpanan yang direkomendasikan dan tidak mengalami degradasi yang signifikan selama penyimpanan (9). Dengan alasan tersebut, diusulkan perubahan pada proses penimbangan material, yaitu menghilangkan proses penimbangan “fresh” menjadi penimbangan semua material dilakukan dalam satu waktu. Namun, usulan ini berisiko terutama terhadap stabilitas material dan mutu produk akhir akibat perpanjangan waktu penyimpanan material yang sebelumnya ditimbang “fresh” (6).
Risiko-risiko yang dapat muncul dari perubahan proses penimbangan “fresh” perlu dikaji sebelum perubahan ini diimplementasikan. Kajian risiko dilaksanakan untuk mengantisipasi kemungkinan terjadinya suatu konsekuensi tidak diinginkan yang dilakukan sebelum melaksanakan sebuah proses baru ataupun saat akan melakukan sebuah perubahan (10). Penilaian risiko ini dikaji melalui manajemen risiko mutu, yaitu pendekatan sistematis untuk memantau, mengendalikan, mengomunikasikan, dan meninjau risiko mutu. Tahapan pada manajemen risiko mutu terdiri dari mengidentifikasi risiko, menganalisis risiko, mengambil keputusan untuk mengurangi atau menerima risiko tersebut, dan mengevaluasi risiko untuk melihat efek tindakan yang diambil (11).
Salah satu metode dalam analisis risiko adalah Failure Modes and Effects Analysis (FMEA). FMEA merupakan suatu metode yang secara efisien dapat mengidentifikasi potensi kegagalan untuk meningkatkan kualitas dan keamanan sistem yang kompleks, serta menganalisis usulan tindakan korektif untuk mengurangi dampak kegagalan tersebut (12,13). Kelebihan dari metode ini adalah mampu menjabarkan risiko dengan lebih luas dan mendalam karena penilaian risiko tidak hanya ditentukan oleh satu kriteria saja, melainkan berdasarkan tiga kriteria penilaian (14). Dalam FMEA, nilai risiko ditentukan berdasarkan tingkat keparahan, tingkat probabilitas, dan tingkat pendeteksian. Ketiga faktor tersebut akan dikalikan untuk menghitung Risk Priority Number (RPN). Di mana semakin tinggi nilai RPN, maka semakin tinggi risiko yang mungkin terjadi (15). Oleh karena itu, metode ini dapat digunakan dalam kajian risiko untuk mengidentifikasi, menganalisis, dan mengevaluasi risiko yang mungkin timbul akibat perubahan proses penimbangan material “fresh” dan penimbangan material yang belum dilakukan studi batas masa simpan setelah penimbangan terhadap kualitas produk dan seluruh aspek yang terdampak.
Meskipun penimbangan “fresh” umum diterapkan oleh industri farmasi untuk menjaga stabilitas material, tetapi batas waktu 24 jam yang digunakan oleh industri X masih bersifat preventif dan belum sepenuhnya berbasis data ilmiah. Dengan demikian, terdapat research gap dalam hal kajian ilmiah terkait belum pernah dilakukan kajian risiko terhadap perubahan proses penimbangan menggunakan metode FMEA. Oleh karena itu, penelitian ini penting dilakukan untuk memberikan dasar ilmiah serta analisis risiko yang komprehensif, sehingga perubahan proses penimbangan dapat dilakukan secara efisien, tetap sesuai dengan kebutuhan industri farmasi untuk menyeimbangkan efisiensi proses dengan jaminan mutu produk, serta memenuhi tuntutan regulasi CPOB.
Metode
Kajian risiko ini menggunakan pendekatan manajemen risiko mutu sesuai dengan pedoman International Council for Harmonisation (ICH) Q9 dan ICH Q14 untuk mengidentifikasi, menganalisis, dan mengevaluasi risiko akibat perubahan proses penimbangan material “fresh“. Kajian risiko dianjurkan untuk mengevaluasi pengembangan prosedur yang bertujuan untuk mengurangi risiko yang dapat memengaruhi kinerja prosedur (16). Proses manajemen risiko mutu terdiri dari beberapa tahap seperti pada Gambar 1.
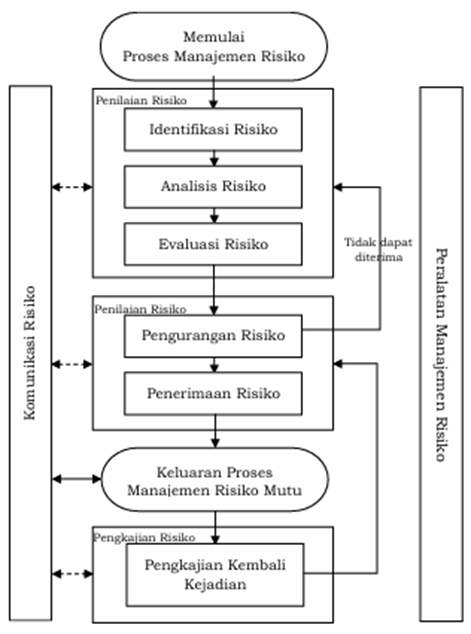
Gambar 1 Alur Proses Manajemen Risiko Mutu (4)
Pengkajian Risiko
Pengkajian risiko terdiri dari.
1.Identifikasi risiko merupakan tahapan untuk mengidentifikasi risiko yang merujuk pada deskripsi risiko dan konsekuensi yang mungkin terjadi. Deskripsi dapat mencakup kemungkinan risiko, akar penyebab risiko, dan kontrol proses saat ini. Hasil identifikasi risiko menjadi dasar untuk penentuan langkah lebih lanjut dalam proses manajemen risiko mutu (11).
2.Analisis risiko merupakan tahapan untuk mengestimasi risiko secara kuantitatif yang dikaitkan dengan tingkat keparahan dampak risiko (severity), kemungkinan kejadian risiko (occurence), dan kemampuan pendeteksian risiko (detectability) (11).
Analisis risiko dilakukan dengan membandingkan risiko yang teridentifikasi dan menganalisis risiko dengan kriteria risiko yang ditentukan pada Tabel 1. Kriteria risiko tersebut mengacu pada Standar Operasional Prosedur (SOP) industri X terkait Manajemen Risiko Mutu.
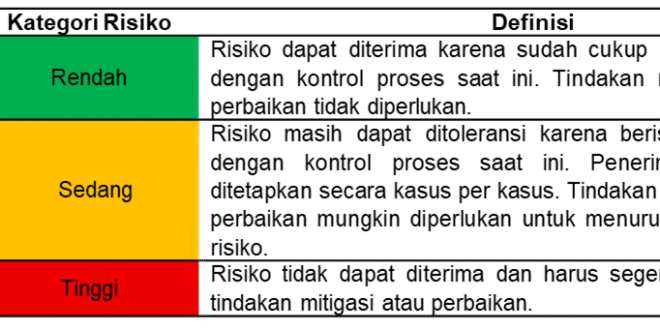
Tabel 1. Kriteria Risiko (17,18)
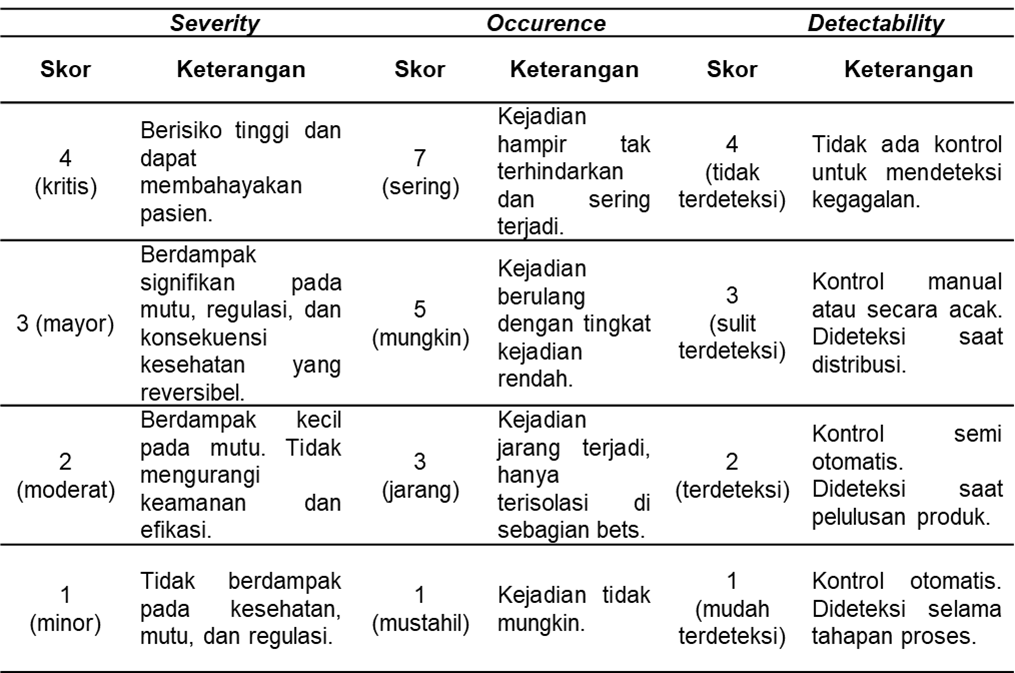
3. Evaluasi risiko merupakan tahapan untuk menentukan tingkat risiko berdasarkan perhitungan nilai RPN. RPN merupakan hasil perkalian ketiga parameter yaitu severity, occurrence, dan detectability (19). Kategori risiko berdasarkan nilai RPN terdapat pada Tabel 2.
Tabel 2. Kategori Risiko Berdasarkan Nilai RPN (11,20,21)

Pengumpulan dan Analisis Data Pendukung
Pengumpulan dan analisis data pendukung terdiri dari.
Tren Data Hasil Pengujian Produk Akhir
Untuk mendukung dari penilaian risiko tersebut dilakukan analisis data historis terhadap produk akhir berupa sediaan topikal dan oral yang diproduksi dari Agustus 2024-Mei 2025. Data yang dianalisis meliputi tren hasil pengujian parameter fisika, kimia, mikrobiologi, dan kadar zat aktif dari produk. Data-data tersebut dianalisis untuk menilai konsistensi mutu produk akhir ketika material mengalami penyimpanan hasil timbang dengan durasi yang bervariasi.
Bracketing Material Berdasarkan Risiko
Bracketing merupakan metode yang bersifat tereduksi di mana tidak semua sampel dari setiap kombinasi faktor diuji (22). Metode ini dipilih untuk menilai risiko stabilitas material berdasarkan parameter pada Tabel 3, sehingga dapat menentukan prioritas material dalam studi penentuan batas masa simpan material setelah penimbangan. Kriteria penilaian ditetapkan sebagai berikut: tidak berisiko diberi nilai 0, risiko rendah diberi nilai 1, risiko sedang diberi nilai 2, dan risiko berat diberi nilai 3. Hasil bracketing ini akan digunakan untuk menentukan marker atau prioritas material berisiko tinggi yang memerlukan studi penentuan batas masa simpan material setelah penimbangan.
Tabel 3. Parameter Bracketing Material (22,23)
Hasil
Proses penimbangan “fresh” menimbulkan inefisiensi dalam alur produksi karena membatasi fleksibilitas perencanaan, sehingga berpotensi menyebabkan penundaan produksi (8). Hasil pengkajian terkait risiko kegagalan dari perubahan proses penimbangan “fresh” tercantum pada Tabel 4. Pengkajian dilakukan berdasarkan data yang diperoleh dari studi literatur dan operasional aktual industri X, yang meliputi kajian dampak degradasi kimia, fisika, dan mikrobiologi pada material; daftar Masa Simpan Material Setelah Penimbangan; SOP penimbangan dan penyimpanan material hasil timbang; serta data historis penyimpanan material yang dikaitkan dengan hasil pemeriksaan produk akhir yang memenuhi spesifikasi. Berdasarkan hasil identifikasi dan evaluasi risiko, terdapat tiga risiko dengan kategori sedang pada penyimpanan material hasil timbang.
Tabel 4. Hasil Pengkajian Risiko

Untuk membuktikan tidak terdapat penyimpangan mutu dari penimbangan tidak “fresh”, dilakukan studi untuk melihat data historis tren hasil pengujian produk akhir seperti terlihat pada Tabel 5. Parameter pengujian fisika yang dianalisis di industri X terdiri dari disolusi, dimensi, gramatur, pemerian, kadar air, pH, dan uji kebocoran. Parameter kimia meliputi identifikasi, kadar, dan kemurnian. Parameter mikrobiologi meliputi uji pertumbuhan mikrobiologi. Selain itu, dilakukan studi bracketing dan penentuan prioritas material yang akan diuji dalam studi penentuan batas masa simpan material setelah penimbangan pada Tabel 6.
Tabel 5. Tren Data Hasil Pengujian Produk Akhir
Keterangan:
MS = Memenuhi Syarat
Seluruh material telah dianalisis risikonya dengan metode bracketing. Hasil bracketing dengan skor < 5 diinterpretasikan sebagai risiko rendah, skor 5–10

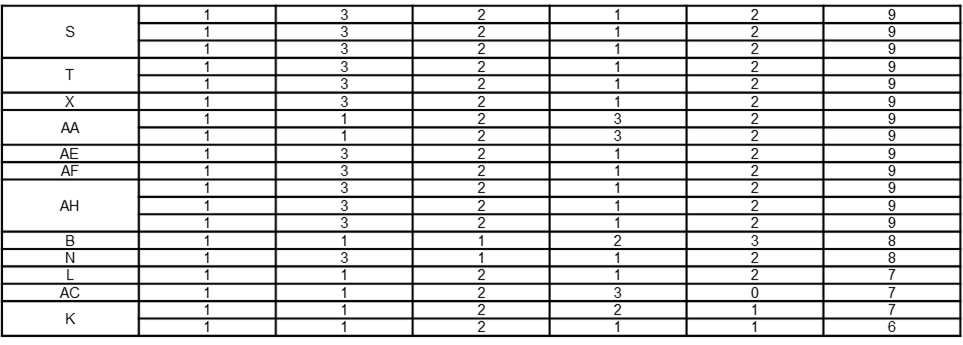
diinterpretasikan sebagai risiko sedang, dan skor ≥ 10 diinterpretasikan sebagai risiko tinggi (22). Berdasarkan hasil bracketing tersebut, terdapat 18 material dengan risiko tinggi dan 15 material dengan risiko sedang. Material dengan risiko tinggi diusulkan menjadi marker dalam studi penentuan batas masa simpan material setelah penimbangan. Hal tersebut dilakukan karena material dengan risiko tinggi dianggap paling kritis dan sensitif terhadap perubahan kondisi penyimpanan, sehingga dapat merepresentasikan ketidakstabilan yang dapat terjadi pada material dengan risiko sedang maupun rendah (22,24).
Tabel 6. Bracketing Material Berdasarkan Risiko

Pembahasan
Industri farmasi memiliki peran vital dalam menjaga kesehatan masyarakat global. Industri farmasi bertanggung jawab untuk menyediakan obat-obatan yang berkualitas, aman, dan efektif dalam mendukung dan memelihara tingkat kesehatan masyarakat (25). Oleh karena itu, mutu obat harus dijaga selama siklus hidup obat, termasuk dari tahapan awal produksi obat, yaitu penimbangan material.
Manajemen risiko mutu bertujuan untuk mengendalikan risiko dengan mengidentifikasi berbagai potensi kegagalan mutu, sehingga dapat meminimalkan risiko dan memungkinkan industri farmasi untuk memproduksi produk yang bermutu dan aman bagi pasien (26). Kajian risiko terhadap perubahan proses penimbangan “fresh” dilaksanakan dengan metode FMEA. Kajian risiko yang dilaksanakan menunjukkan bahwa sebagian besar material yang harus ditimbang secara “fresh” belum memiliki data masa simpan setelah penimbangan dan beberapa material yang telah diuji menunjukkan penurunan mutu pada hari ke-14. Di samping itu, berdasarkan hasil analisis terhadap data historis tren hasil pengujian produk akhir pada Tabel 5, menunjukkan bahwa hasil pengujian kadar zat aktif, parameter fisika, kimia, dan mikrobiologi dari produk akhir yang menggunakan zat aktif dengan durasi penyimpanan lebih dari satu hari tetap menunjukkan hasil yang memenuhi spesifikasi. Hal ini menunjukkan bahwa asumsi terhadap mutlaknya proses penimbangan “fresh” perlu ditinjau ulang.
Berdasarkan hasil identifikasi risiko, terdapat tiga risiko dengan kategori sedang yaitu pada tahapan penyimpanan material hasil timbang. Material hasil timbang yang telah dibuka dari kemasan primernya dapat mengalami degradasi kimia dan fisika akibat kontak dengan lingkungan luar. Ketidakstabilan material melalui perubahan kimia diakibatkan oleh adanya reaksi kimiawi yang mengakibatkan terjadinya penurunan kadar dan terbentuknya produk sampingan atau impurity (27). Faktor-faktor lingkungan seperti suhu, cahaya, kelembapan, dapat mempercepat reaksi kimia yang memengaruhi stabilitas material (28). Ketidakstabilan secara fisika menyebabkan perubahan sifat fisik dari suatu material seperti kelarutan, pemerian, titik didih, viskositas, homogenitas, dan titik leleh (29). Stabilitas material harus dijaga karena stabilitas tersebut dapat menjaga dan menjamin mutu suatu produk bahkan menjadi salah satu syarat dalam pengajuan registrasi obat (30). Risiko yang terakhir adalah potensi kontaminasi mikrobiologi pada material hasil timbang. Adanya kontaminasi tersebut berdampak pada kesehatan pasien, baik melalui infeksi yang disebabkan langsung oleh mikroorganisme itu sendiri, maupun melalui toksin yang diproduksi olehnya (31). Selain itu, kontaminasi mikrobiologi juga dapat menyebabkan penurunan kualitas obat, termasuk perubahan sifat fisikokimia, perubahan organoleptik, degradasi zat aktif, dan penurunan efektivitas zat pengawet (32). Risiko yang mungkin terjadi tersebut perlu dikendalikan, sehingga tidak berdampak pada kualitas, keamanan, dan efikasi dari produk akhir (33).
Dengan adanya kontrol proses penimbangan saat ini di industri X yang mengacu pada CPOB seperti adanya kontrol lingkungan berupa monitoring suhu dan kelembapan area penimbangan, disposisi hasil kajian yang membatasi penyimpanan material hasil timbang selama tiga hari, pemindahan tempat penyimpanan material ke gudang Controlled Room Temperature (CRT) saat penyimpanan sudah melebihi tiga hari, sosialisasi dan pelatihan disposisi hasil kajian tersebut kepada operator, adanya SOP untuk mengontrol sanitasi higiene, dan adanya Raw Material Specification (RMS) serta Finished Product Specification (FPS), risiko-risiko tersebut dikategorikan ke dalam tingkatan sedang. Oleh karena itu, dari hasil identifikasi risiko tersebut perlu dirumuskan langkah mitigasi risiko untuk menurunkan risiko hingga tingkatan yang dapat diterima, mendeteksi serta mencegah kegagalan, dan meningkatkan pengawasan mutu produk (34,35). Terdapat dua langkah mitigasi risiko yang diusulkan yaitu merevisi daftar masa simpan material setelah penimbangan sesuai dengan disposisi hasil kajian dan melakukan studi batas masa simpan material setelah penimbangan. Hasil evaluasi nilai RPN setelah adanya langkah mitigasi risiko tersebut menunjukkan penurunan risiko menjadi tingkat risiko rendah.
Metode bracketing dipilih untuk penentuan prioritas material yang akan diuji pada studi penentuan batas masa simpan material setelah penimbangan. Bracketing merupakan suatu desain metode yang bersifat tereduksi di mana tidak semua sampel dari setiap kombinasi faktor diuji. Desain ini harus memiliki kemampuan untuk mewakili semua sampel secara memadai. Bracketing dapat menjadi alternatif yang sesuai jika melibatkan beberapa faktor desain, termasuk pada faktor ekstrem dari desain tertentu yang diuji di semua sampel seperti dalam desain lengkap (22). Berdasarkan hasil bracketing material berdasarkan risiko pada Tabel 6 telah ditetapkan prioritas material yang akan diuji dalam studi penentuan batas masa simpan material setelah penimbangan, yaitu material A, C, E, F, G, I, J, O, P, Q, R, U, V, W, Y, Z, AD, dan AG. Bracketing tersebut didasarkan pada parameter risiko material yaitu penggunaan material pada jenis sediaan yang diproduksi, suhu penyimpanan, volume produksi, jenis material sebagai zat aktif atau eksipien, dan sifat stabilitas material.
Dengan mempertimbangkan seluruh hasil kajian dan kontrol proses yang tersedia, perubahan proses penimbangan “fresh” dinilai dapat diterapkan tanpa meningkatkan risiko signifikan terhadap mutu produk. Perubahan proses penimbangan ini dapat menimbulkan efisiensi dan memberikan fleksibilitas dalam alur produksi. Berdasarkan pedoman CPOB, pendekatan manajemen risiko mutu diperlukan dalam mengidentifikasi dan mengendalikan risiko masalah mutu pada perubahan proses (4).
Rekomendasi tindakan mitigasi perlu diterapkan untuk menekan risiko menjadi tingkatan yang dapat diterima. Keberhasilan implementasi perubahan proses penimbangan “fresh” ini sangat bergantung pada konsistensi penerapan prosedur dan tindakan mitigasi, sehingga diperlukan evaluasi kembali terhadap implementasi perubahan tersebut.
Kesimpulan
Perubahan proses penimbangan “fresh” menjadi satu waktu perlu dilakukan industri X karena kebutuhan efisiensi waktu maupun sumber daya proses produksi. Ketika dilakukan perubahan proses, perlu dilakukan analisis risiko. Metode Failure Modes and Effects Analysis (FMEA) merupakan salah satu metode yang dapat digunakan untuk menilai risiko dari perubahan proses penimbangan “fresh”. Hasil pengkajian risiko dengan FMEA menunjukkan bahwa terdapat total tiga risiko yang termasuk kategori sedang. Perubahan proses penimbangan dapat dipertimbangkan sebagai opsi efisiensi produksi, dengan beberapa langkah mitigasi yaitu merevisi daftar masa simpan material setelah penimbangan sesuai dengan disposisi hasil kajian dan melakukan studi batas masa simpan material setelah penimbangan dengan prioritas material yang akan diuji adalah material A, C, E, F, G, I, J, O, P, Q, R, U, V, W, Y, Z, AD, dan AG. Langkah mitigasi tersebut bertujuan untuk menurunkan risiko mutu akibat perubahan proses penimbangan, meningkatkan jaminan kualitas berbasis data ilmiah, dan mendukung kepatuhan regulasi CPOB. Pada masa mendatang, penelitian ini dapat menjadi dasar dalam pelaksanaan studi penentuan batas masa simpan material setelah penimbangan serta menjadi referensi industri farmasi lain dalam menerapkan strategi efisiensi serupa tanpa mengurangi mutu produk.
Daftar Pustaka
1. Alsaidalani R, Elmadhoun B. Quality Risk Management in Pharmaceutical Supply Chain, Warehousing and Dispensing -Practical Case Study from Sterile Pharmaceutical Industry. Int J Pharm Sci Rev Res. 2021 Jun 15;68(2):155–64.
2. Annisa V. Kajian Penerapan Good Manucfacturing Practice (GMP) di Industri Farmasi Indonesia. Majalah Farmasetika. 2024;9(4):351–66.
3. Defriandi M, Ramdhan DH. Evaluasi Pengendalian Teknik Pajanan Active Pharmaceutical Ingredient (API) di Proses Penimbangan Obat PT. XY. PREPOTIF Jurnal Kesehatan Masyarakat. 2022;6(2):1184–91.
4. BPOM. Peraturan Badan Pengawas Obat dan Makanan Nomor 7 Tahun 2024 Tentang Standar Cara Pembuatan Obat yang Baik. Jakarta: BPOM; 2024.
5. Veronica N, Heng PWS, Liew CV. Ensuring Product Stability – Choosing the Right Excipients. J Pharm Sci. 2022 Aug 1;111(8):2158–71.
6. Yuliani SH, Waskita SS, Dwiastuti R, Immanuel H. Dasar-Dasar Stabilitas Obat: Mekanisme dan Faktor yang Berpengaruh. Yogyakarta: Sanata Dharma University Press; 2025.
7. Nabila, Jalaluddin. Analisis Efisiensi Biaya Bahan Baku Menggunakan Metode Just In Time (JIT) Studi Kasus CV. Soya Aula di Aceh Besar. Jurnal Ilmiah Mahasiswa Ekonomi Akuntansi (JIMEKA). 2021;6(3):375–84.
8. Kumar V, Shaik MA. Improved Scheduling Model for a Multistage Biopharmaceutical Process in a Multiproduct Facility. Chemical Engineering Research and Design. 2024;207:518–38.
9. Darji MA, Lalge RM, Marathe SP, Mulay TD, Fatima T, Alshammari A, et al. Excipient Stability in Oral Solid Dosage Forms: A Review. AAPS PharmSciTech. 2018;19(1):12–26.
10. Zio E. The Future of Risk Assessment. Reliab Eng Syst Saf. 2018;177:176–90.
11. ICH. ICH Guideline Q9 on Quality Risk Management. London: European Medicines Agency; 2015.
12. El-Awady SMM. Overview of Failure Mode and Effects Analysis (FMEA): A Patient Safety Tool. Global Journal on Quality and Safety in Healthcare. 2023 Feb 1;6(1):24–6.
13. Bartolomé E, Benítez P. Failure Mode and Effect Analysis (FMEA) to Improve Collaborative Project-Based Learning: Case Study of a Study and Research Path in Mechanical Engineering. International Journal of Mechanical Engineering Education. 2022 Apr 1;50(2):291–325.
14. Kurnianto MF, Kusnadi, Azizah FN. Usulan Perbaikan Risiko Kecelakaan Kerja dengan Metode Failure Mode and Effect Analysis (FMEA) dan Fishbone Diagram. Selaparang: Jurnal Pengabdian Masyarakat Berkemajuan. 2022;6(1):18–23.
15. Kim J, Miller B, Siddiqui MS, Movsas B, Glide-Hurst C. FMEA of MR-Only Treatment Planning in the Pelvis. Adv Radiat Oncol. 2019 Jan 1;4(1):168–76.
16. ICH. ICH Guideline Q14 on Analytical Procedure Development. Amsterdam: European Medicines Agency; 2023.
17. Hidayatullah R, Muliatna IM. Study Failure Mode and Effects Analysis (FMEA) sebagai Identifikasi Bahaya dan Upaya Pencegahan Kecelakaan Kerja di PT. PJB UBJ O & M Tanjung Awar-Awar. Jurnal Pendidikan Teknik Mesin. 2017;06(02):116–23.
18. Damayanti C, Hasanah AN. Penilaian Risiko Kontaminasi Silang pada Area Produksi pada Salah Satu Industri Farmasi di DKI Jakarta. Majalah Farmasetika. 2023 Jul 18;8(5):424–46.
19. Nurwulan NR, Veronica WA. Implementation of Failure Mode and Effect Analysis and Fault Tree Analysis in Paper Mill: A Case Study. Jurnal Rekayasa Sistem Industri. 2020 Oct 27;9(3):171–6.
20. Musyaffa HA, Roestan MR, Nurrasjid ES, Kustiyawan I. Kajian Risiko pada Proses Penyimpanan dan Pendistribusian Bahan Baku di Gudang Industri Farmasi dengan Pendekatan Metode Failure Mode and Effect Analysis. Jurnal Ilmu Kesehatan dan Gizi. 2024 Jul 31;2(3):202–11.
21. Simanjuntak EUE, Megantara S. Kajian Risiko Proses Penyediaan Produk Semisolid Industri X di Cikarang Selatan. Majalah Farmasetika. 2023 Oct 22;8(1):44–55.
22. ICH. ICH Topic Q1D Bracketing and Matrixing Designs for Stability Testing of Drug Substances and Drug Products. London: European Medicines Agency; 2002.
23. Charoo NA, Akanji O, Rahman Z, Khan AA, Badshah A. Risk-Based Approach for Defining Retest Dates for Active Pharmaceutical Ingredients and Excipients. Pharmaceuticals. 2024 Jul 1;17(7):1–15
24. Latoz C, Larkin L, Huynh-Ba K. Stability Considerations for Drug-Device Combination Products-21 CFR Part 4 Update. AAPS Open. 2023 May 1;9(1):1–14.
25. Fazila E, Megantara S, Anastasya G. Analisis Risiko Kualifikasi Pemasok dan Pendekatan Mitigasi Risikonya dalam Manajemen Rantai Pasok Industri Farmasi. Jurnal Mahasiswa Ilmu Kesehatan. 2025 Apr 8;3(2):69–87.
26. Kumar JS. Quality Risk Management – CAPA to Prevent Potential Quality Issues. Asian Journal of Pharmaceutical Research and Development. 2017;5(1):1–11.
27. Gharge VS, Mohite VL, Jadhav BS, Patil ND, Jagdale MR, et al. Advancements in Stability Assessment: A Novel Method for Impurity Profiling in Montelukast and Fexofenadine Dosage Forms by RP-HPLC. Discover Chemistry. 2025 Jul 19;2(1):1–16.
28. Novianti HF, Azmi DA, Weya E, Jamilah S, Pahlevi MR, Jafar G, et al. Teknik Menghindari Kerusakan Zat Aktif Akibat Paparan Suhu dan Kelembapan. Jurnal Ilmu Kesehatan Umum, Psikolog, Keperawatan dan Kebidanan. 2025 Feb 7;3(1):146–55.
29. Gabrič A, Hodnik Ž, Pajk S. Oxidation of Drugs during Drug Product Development: Problems and Solutions. Pharmaceutics. 2022 Feb 1;14(2):1–19.
30. Saputro MR, Wardhana YW, Wathoni N. Stabilitas Hidrogel dalam Penghantaran Obat. Majalah Farmasetika. 2021 Dec 6;6(5):421–35.
31. Amalia MN, Nuryastuti T, Rahmawati F. Kontaminasi Bakteri Pada Pencampuran Sediaan Intravena dan Lingkungan Pencampuran Sediaan Intravena di Rumah Sakit. Majalah Farmaseutik. 2022 Dec 5;18(4):406–14.
32. Tyski S, Burza M, Laudy AE. Microbiological Contamination of Medicinal Products —Is It a Significant Problem? Pharmaceuticals. 2025 Jul 1;18(7):1–30.
33. Ismael OA, Ahmed MI. Using Quality Risk Management in Pharmaceutical Industries: A Case Study. Quality – Access to Success. 2020;21(178):106–13.
34. Azzahra AM, Sriwidodo. Penilaian Risiko menggunakan Metode Failure Mode and Effects Analysis (FMEA) terkait Kontaminasi Silang pada Area Pengemasan di Industri Farmasi “XYZ.” Obat: Jurnal Riset Ilmu Farmasi dan Kesehatan. 2024 Jul 31;2(5):1–11.
35. Nainggolan E, Efendi S. Manajemen Risiko Mutu sebagai Salah Satu Proses Pemastian Kualitas Produk di Industri Farmasi. Medic Nutricia: Jurnal Ilmu Kesehatan. 2025;12(1):1–8.
cara mengutip artikel
https://jurnal.unpad.ac.id/farmasetika/rt/captureCite/66711/26401
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3