Majalah Farmasetika, 9 (4) 2024, 339-350
https://doi.org/10.24198/mfarmasetika.v9i4.56399
Artikel Penelitian
Meigita Indah Farkhani1*, Ida Musfiroh1,2
1Program Studi Profesi Apoteker, Fakultas Farmasi, Universitas Padjadjaran, Jatinangor, 45363
2Departemen Analisis Farmasi dan Kimia Medisinal, Fakultas Farmasi, Universitas Padjadjaran, Jatinangor 45363
*E-mail : meigita18001@mail.unpad.ac.id
(Submit 19/07/2024, Revisi 30/07/2024, Diterima 06/08/2024, Terbit 13/08/2024)
Abstrak
Dalam memenuhi mutu suatu produk di industri farmassi, perlu dilakukan pengawasan salah satunya pada sistem tata udara dan mesin sterilisator untuk memastikan produk yang dihasilkan memiliki mutu yang konsisten baik dengan proses kualifikasi yang mengacu pada CPOB dan EU GMP sebagai pedoman produk yang dipasarkan di dalam negeri dan wilayah Eropa. Dengan adanya perkembangan pada pedoman yang digunakan, selanjutnya dilakukan analisa gap antara pedoman terbaru dengan protokol kerja yang digunakan. Protokol kualifikasi kinerja HVAC dan mesin sterilisator dibandingkan dengan pedoman, lalu dilakukan analisa gap, selanjutnya hasil dari analisis ini disajikan secara deskriptif. Hasil dari analisis gap ini ditemukan adanya gap antara pedoman dengan protokol, yang mana penyesuaian batas penerimaan recovery test, dilakukan penentuan CCS, pembuatan risk assessment untuk pemetaan titik pemantauan kualitas udara dan lingkungan, melakukan penyusunan protokol kerja kualifikasi tunnel sesuai parameter kritis yang diatur pada pedoman, dan melakukan risk assessment untuk proses kualifikasi autoclave. Maka dari itu, berdasarkan berdasarkan gap yang ditemukan ini, perlu dilakukan perbaikan/perubahan pada protokol kerja sehingga protokol yang digunakan pada proses kualifikasi selanjutnya lebih relevan terhadap pedoman yang digunakan dan dapat memberikan tingkat kepercayaan hasil yang lebih baik.
Kata kunci: ifikasi, CPOB, EU GMP
Teks Lengkap:
Pendahuluan
Dalam memenuhi standar mutu suatu produk di industri farmasi, maka perlu dilakukan pengaturan terhadap beberapa hal seperti bahan baku, proses produksi, peralatan, dan lingkungan [2]. Selanjutnya perlu dilakukan kontrol untuk memastikan bahwa secara keseluruhan sudah sesuai pengaturan awal [1]. Dari sisi proses produksi, untuk memastikan mutu produk yang akan dihasilkan konsisten baik, perlu dilakukan kualifikasi terhadap sarana penunjang dan peralatan yang digunakan [3,24]. Kualifikasi merupakan suatu proses pemastian terhadap sistem penunjang, peralatan dan mesin yang digunakan sesuai dengan desain yang terdokumentasi, terpasang sesuai gambaran teknik, beroperasi sesuai spesifikasi, dan dapat menghasilkan produk yang sesuai dengan syarat mutu [3]. Kualifikasi Proses ini terdiri dari 4 tahap yaitu kualifikasi desain berdasarkan URS (User Requierment Spesification) yang dibuat oleh user, kualifikasi instalasi, kualifikasi operasional, dan kualifikasi kinerja untuk memastikan kinerja dari sistem penunjang atau mesin yang digunakan sesuai dengan standar kerja [3,5,28].
Salah satu sistem penunjang yang perlu dikualifikasi adalah sistem tata udara (Heating, Ventilation, and Air Conditioning atau HVAC) serta mesin sterilisator tunnel dan autoclave [6,9,21]. Proses kualifikasi ini merupakan salah satu aspek yang terdapat Peraturan Badan Pengawas Obat dan Makanan Nomor 34 Tahun 2018 tentang Pedoman Cara Pembuatan Obat yang Baik. Selain CPOB, EU GMP pun mengatur terkait kualifikasi dan menyatakan bahwa setiap sistem penunjang dan peralatan harus dinyatakan lulus dari proses kualifikasi untuk digunakan produksi [8]. Pada Mei 2024 telah diresmikan standar CPOB 2024 dengan peraturan BPOM Nomor 7 Tahun 2024 tentang Standar Cara Pembuatan Obat yang Baik, dimana terdapat perubahan dan penambahan dari Pedoman CPOB 2018 yang selanjutnya seluruh industri farmasi di Indonesia harus memulai untuk melakukan pengkajian dan transisi dari CPOB 2018 ke CPOB 2024. Hal ini dilakukan selain untuk pemenuhan aturan, tentunya untuk memastikan setiap prosedur dan syarat penerimaan yang digunakan pada protokol kerja adalah yang terbaru dan relevan, sehingga luaran dari proses kualifikasi yang dilakukan valid.
Pada artikel ini yang menjadi fokus adalah melakukan gap analysis pada protokol kerja kualifikasi HVAC, mesin sterilisator tunnel, dan autoclave di area produksi steril di suatu industri dengan aturan yang ada pada CPOB 2018, CPOB 2024, dan Annex 1 EU GMP. Urgensi dari kualifikasi ini untuk menentukan parameter kritis dan non kritis pada setiap alat tersebut. Gap analysis merupakan suatu instrumen dan proses yang digunakan untuk menentukan perbedaan (gap) antara kondisi yang saat ini terjadi dengan kriteria kontrol yang diharapkan, yaitu kriteria yang tercantum pada pedoman. Suatu gap terbentuk dengan adanya aturan atau prosedur yang tidak sepenuhnya memenuhi ba tasan yang dipersyaratkan. Sehingga dengan dilakukannya gap analysis ini dapat menunjukkan adanya gap antara protokol yang ada dengan pedoman yang digunakan dan standar CPOB 2024 yang masih dalam masa transisi suatu industri. Setelah ditemukannya gap yang ada, selanjutnya dapat dilakukan analisa untuk memperkecil atau menghilangkan gap yang ada sehingga dapat memenuhi standar yang ada pada pedoman [11,20,26].
Metode
Proses analisis gap ini dilakukan pada bulan Juni di salah satu industri farmasi dengan metode membandingkan antara protokol kualifikasi kinerja sarana penunjang, mesin tunnel, dan autoclave dengan pedoman yang digunakan yaitu CPOB dan EU GMP sebagai dasar pedoman yang harus dipenuhi suatu industri dengan produk yang masuk ke pasar dalam negeri dan Eropa. Adapun data dikumpulkan yang selanjutnya dianalisa perbedaannya dan hasilnya dituangkan secara deskriptif. Alur metode analisis gap ditunjukkan pada Gambar 1 berikut : Trambahkan urgenci kvaliadsi HVAC Dibuat bagan alir akan lebih baik

Hasil
Hasil dari gap analysis yang dilakukan terhadap 22 protokol kualifikasi kinerja HVAC, mesin tunnel, dan mesin autoclave terhadap standar CPOB dan EU GMP dapat dilihat pada Tabel 1 di bawah ini.
Tabel 1 Tabel hasil gap analysis protokol kualifikasi kinerja di suatu industri farmasi terhadap CPOB dan EU GMP



Diskusi
Industri farmasi merupakan salah satu industri yang memiliki tingkat pengawasan yang ketat utamanya di Indonesia. Tujuan dari pengawasan yang ketat ini adalah untuk memberikan produk dengan mutu yang baik, sesuai dengan efikasi yang diharapkan, dan juga menjaga agar produk yang dihasilkan aman untuk digunakan dalam jangka waktu tertentu. Untuk mencapai 3 hal tersebut, suatu industri farmasi harus dapat mengontrol hampir keseluruhan aspek untuk mencegah hasil yang inkonsisten. Hal-hal yang perlu diatur telah tertuang pada CPOB dan EU GMP [3,8].
Dengan adanya pembaharuan dari Pedoman CPOB 2018 ke Standar CPOB 2024, dilakukan identifikasi terhadap Bab Kualifikasi dan Validasi serta Aneks 1 Produksi Sediaan Steril pada kedua pedoman tersebut. Didapatkan bahwa secara prosedural, aturan, ataupun standar penerimaan tidak terjadi perubahan. Selanjutnya mengumpulkan dokumen protokol kualifikasi kinerja HVAC, mesin autoclave, dan tunnel di area produksi steril, didapatkan 22 (dua puluh dua) dokumen protokol. Selanjutnya dilakukan gap analysis pada setiap dokumen protokol terhadap Standar CPOB 2024 dan Annex 1 EU GMP dengan pembahasan sebagai berikut:
1. Kualifikasi Kinerja HVAC di area kelas A.B.C. dan D.
HVAC merupakan suatu sarana penunjang yang dapat mengontrol kondisi suatu ruangan steril terhadap partikel dan mikroba. HVAC bekerja dengan mensuplai udara yang telah disaring sesuai dengan syarat penerimaan dari setiap ruangannya dan mensirkulasikan udara dalam ruangan tersebut [29]. Selain melakukan kontrol terhadap partikel dan
a) Pada protokol menyatakan parameter kualifikasi kinerja HVAC pada ruang dengan kelas kebersihan A yang dilakukan pemeriksaan, yaitu:
– Pengukuran jumlah partikel udara
– Pengukuran suhu dan RH
– Pengukuran air velocity
– Pemantauan mikroba
Lalu untuk ruang dengan kelas kebersihan B, C, dan D parameter tambahannya adalah penentuan Differential Pressure dan Flow Direction yang merupakan perbedaan tekanan antara ruangan yang terhubung. Dalam penentukan perbedaan tekanan tiap ruangan ini perlu memperhatikan juga fungsi ruangan tersebut dan posisi dari operator yang bekerja di ruangan tersebut [32]. Serta mengganti pengukuran air velocity menjadi pengukuran air change. Parameter-parameter tersebut telah melampaui syarat minimum yang ditetapkan oleh Annex 1 EU Guidelines for GMP dengan tetap melakukan pemantauan cemaran mikroba pada proses rekualifikasi [8,11,25].
b) Pada Annex 1 EU GMP menyatakan untuk kegiatan kualifikasi ruang kelas A dan B dilakukan setiap 6 bulan, lalu untuk kelas C dan D dilaksanakan setiap 12 bulan. Pada protokol dinyatakan untuk proses rekualifikasi ruang kelas A dan B dalam kondisi at rest dilakukan setiap 6 bulan selama 5 hari, sedangkan untuk ruang kelas C dan D dilakukan setiap 12 bulan selama 5 hari, dan untuk recovery test dilakukan setiap 24 bulan. Informasi pada protokol selain dari CPOB 2018 dan Annex 1 EU Guidelines for GMP, dilengkapi pula dengan informasi dari ISO 14644-1:2015 [8].
c) Pada Annex 1 EU GMP tertulis syarat penerimaan perbedaan tekanan antara ruang beda kelas minimal 10 Pa. Syarat tersebut tercantum pada protokol dan dilengkapi dengan syarat penerimaan perbedaan tekanan antar ruang dengan kelas yang sama dan antar ruang dengan 2 tingkat kelas yang berbeda berdasarkan panduan lain [27].
d) Pada Annex 1 EU Guidelines for GMP tertulis syarat penerimaan velocity pada mesin/ ruang kelas A adalah 0,36 – 0,54 m/s pada area kerja (sebagai area dengan resiko paparan pada produk tinggi). Dengan kecepatan tersebut dapat membentuk aliran udara laminar yang akan membawa kontaminan langsung mengarah ke supply out sehingga mencegah persebaran kontaminan baik itu partikel maupun mikroba ke personel/produk lainnya . Untuk kelas B, C, dan D velocity test harus dilakukan berdasarkan penilaian resiko yang didokumentasikan sebagai bagian dari Contamination Control Strategy (CCS). Namun, velocity test ini juga perlu dilakukan di zona filling dengan arah alir laminar. Syarat yang tercantum pada protokol sesuai dengan yang tertuang pada Annex 1 EU Guidelines for GMP.
e) Pada protokol tercantum syarat penerimaan tingkat pertukaran udara untuk setiap kelas kebersihan dan syarat penerimaan recovery time adalah kurang dari sama dengan 15 menit. Lalu pada Annex 1 EU GMP tidak dicantumkan secara langsung, namun disampaikan bahwa untuk proses klasifikasi dan kualifikasi ruang kebersihan mengacu pada ISO 14644 [8,12].
f) Pada beberapa protokol tidak dicantumkan penilaian resiko dalam penentuan titik-titik pemantauan partikel dan mikroba di setiap ruang kelas, sedangkan pada Annex 1 EU Guidelines for GMP menyatakan perlu adanya risk
assessment area-area yang memiliki potensi resiko paling tinggi. Hal ini didukung dengan informasi pada ISO yang menyatakan hal-hal yang perlu diperhatikan saat menentukan jumlah dan posisi titik pemantauan. Sehingga, disarankan untuk menambahkan hasil risk assessment untuk membuktikan relevansi dari posisi titik pemantauan yang telah dirancang [1].
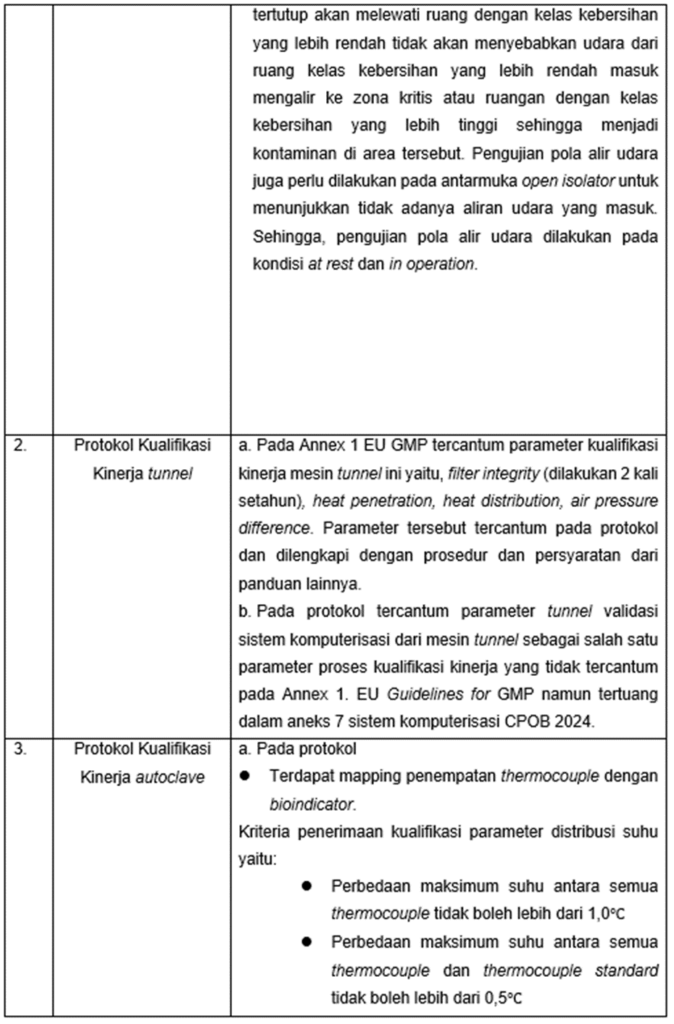
g) Pada protokol dinyatakan bahwa dilakukan pengujian pola aliran udara di ruang kelas steril dengan syarat penerimaan aliran udara yang terbentuk laminer untuk ruang/mesin dengan LAF. Pada Aneks 1 EU GMP dinyatakan pengujian pola alir udara di ruang steril. Salah satunya adalah ketika produk dari proses filling dan tertutup akan melewati ruang dengan kelas kebersihan yang lebih rendah tidak akan menyebabkan udara dari ruang kelas kebersihan yang lebih rendah masuk mengalir ke zona kritis atau ruangan dengan kelas kebersihan yang lebih tinggi sehingga menjadi kontaminan di area tersebut. Pengujian pola alir udara juga perlu dilakukan pada antarmuka open isolator untuk menunjukkan tidak adanya aliran udara yang masuk. Sehingga, pengujian pola alir udara dilakukan pada kondisi at rest dan in operation [8,13,19].
2. Kualifikasi Kinerja Mesin tunnel
Mesin tunnel merupakan mesin depirogenasi yang digunakan industri farmasi dalam proses filling dengan metode aseptik. Prinsip kerja dari mesin tunnel ini adalah dengan depirogenasi dengan metode panas kering untuk destruksi endotoksin pada kemasan primer dengan suhu di rentang 180-250℃dengan durasi kurang dari 30 menit untuk suhu maksimum 250℃[14,24]. Berdasarkan hasil gap analysis yang dilakukan pada protokol kualifikasi kinerja mesin tunnel terhadap pedoman, didapatkan hasil sebagai berikut:
a)Pada Annex 1 EU GMP tercantum parameter kualifikasi kinerja mesin tunnel ini yaitu, filter integrity (dilakukan 2 kali setahun), heat penetration, heat distribution, air pressure difference. Parameter tersebut tercantum pada protokol dan dilengkapi dengan prosedur dan persyaratan dari panduan lainnya [8,22].
b) Pada protokol tercantum parameter tunnel validasi sistem komputerisasi dari mesin tunnel sebagai salah satu parameter proses kualifikasi kinerja yang tidak tercantum pada Annex 1. EU Guidelines for GMP namun tertuang dalam aneks 7 sistem komputerisasi CPOB 2024.
3. Kualifikasi Kinerja Mesin autoclave
autoclave merupakan suatu ruang dengan tekanan tertentu yang digunakan untuk proses industri yang memerlukan suhu dan tekanan yang berbeda dengan tekanan udara. autoclave ini digunakan untuk sterilisasi peralatan yang akan digunakan di area steril. Faktor kritis yang dapat memastikan keberhasilan proses sterilisasi uap adalah waktu, suhu, kelembaban, tekanan, kontak langsung dengan uap, penghilangan udara, dan pengeringan [30]. Parameter kualifikasi kinerja dari mesin autoclave ini yaitu vacuum leak test, Bowie-dick test, heat distribution study, dan heat penetration study. [4,9]. Berdasarkan hasil gap analysis yang dilakukan pada protokol kualifikasi kinerja mesin tunnel terhadap pedoman, didapatkan hasil sebagai berikut:
a)Menurut aneks 1 EU GMP, dalam penentuan peletakan thermocouple untuk melakukan mapping suhu berdasarkan penilaian resiko dari area pada autoclave yang akan digunakan. Namun, penerapan dari protokol kualifikasi kinerja mesin autoclave ini belum menggunakan penilaian resiko yang mempersonalisasi setiap jenis autoclave yang digunakan dalam proses produksi di area steril [8].
b) Menurut aneks 1 EU GMP, kriteria penerimaan dari kualifikasi kinerja mesin autoclave dengan parameter distribusi suhu yaitu:
lVariasi maksimum suhu masing-masing thermocouple.
lVariasi maksimum suhu antarthermocouple.
lPerbedaan maksimum suhu antara thermocouple dengan thermocouple
standar.
Sedangkan yang tertuang pada protokol yaitu,
lPerbedaan maksimum suhu antara semua thermocouple tidak boleh
lebih dari 1,0℃
lPerbedaan maksimum suhu antara semua thermocouple dan
thermocouple standar tidak boleh lebih dari 0,5℃
Namun, perbedaan maksimum suhu antarthermocouple pada pengujian
heat distribution pada ruang autoclave yang kosong berdasarkan artikel
penelitian yang disusun oleh Gitanjali dkk yaitu 1,5℃ [7].
Berdasarkan proses analisa yang dilakukan, ditemukan adanya gap antara protokol yang digunakan dengan pedoman terbaru yang digunakan industri farmasi diantaranya adalah penyesuaian batas penerimaan recovery test, dilakukan penentuan CCS, pembuatan risk assessment untuk pemetaan titik pemantauan kualitas udara dan lingkungan, melakukan penyusunan protokol kerja kualifikasi tunnel sesuai paramter kritis yang diatur pada pedoman, dan melakukan risk assessment untuk proses kualifikasi autoclave.
Kesimpulan
Protokol-protokol kualifikasi kinerja dari HVAC, mesin autoclave, dan mesin tunnel yang ada di salah satu industri farmasi sudah memenuhi aspek kualifikasi yang dipersyaratkan CPOB 2024 dan didukung sejumlah pedoman lainnya. Namun, masih terdapat beberapa protokol yang perlu diperbaharui dari segi metode pelaksanaan kualifikasi maupun batasan penerimaannya untuk dapat memenuhi standar dari EU GMP. Perlu dilakukannya penyesuaian kembali beberapa protokol kerja berdasarkan pedoman yang digunakan sehingga dapat memperkecil gap yang ada dan meningkatkan validitas hasil yang dihasilkan. Sehingga proses kontrol dari produksi yang dilakukan lebih relevan dan lebih baik lagi.
Daftar Pustaka
1. Behrens, D., Schaefer, J., Keck, C.M., Runkel, F.E. Application of Biofluorescent Particle Counters for Real-Time Bioburden Control in Aseptic Cleanroom Manufacturing. Applied Sciences. 2022;12:1-17.
2. BPOM RI. Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 34 Tahun 2018 Tentang Cara Pembuatan Obat yang Baik. Jakarta: BPOM RI; 2018.
3. BPOM RI. Peraturan Badan Pengawas Obat dan Makanan Nomor 7 Tahun 2024 Standar Cara Pembuatan Obat yang Baik. Jakarta: BPOM RI; 2024.
4. Cardoso, J.D.B., Coba, I.V., Torres, J.M.F., Hernandez, L.M., et al. HMC Europe HG-80 autoclave Qualification for Its Use with Solid Material at The Sancti Spiritus (Cuba). Journal of Bacteriology & Mycology. 2021;9(2):99-102.
5. Choudhary, A.N., dan Rawat, J. Validation and Qualification of Heating, Ventilation, Air Conditioning System. Journal of Emerging Technologies and Innovative Research. 2019;6(5):358-366.
6. DeVecchi, F. dan DeSantis, P. ‘Design and Qualification of Controlled Environments’. Agalloco , J.(ed). Handbook of Validation in Pharmaceutical Processes, Fourth Edition. Boca Raton: CRC Press; 2021.
7. Gitanjali, C.C., et al. Performance Qualification of Industrial Steam Sterilizer (autoclave). International Journal of Research and Analytical Reviews. 2022;9(3):512-519.
8. GMP EU. Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Annex 1: Manufacture of Sterile Medicinal Products. European Comission; 2022.
9. Gupta, N.V., dan Shukshith, K.S. Qualification of autoclave. International Journal of PharmTech Research. 2016;9(4):220-226.
10. ISO 14644-1. Classification of air cleanliness by particle concentration; 2015.
11. Kim, S., dan Ji, Y. Gap Analysis. The International Encyclopedia of Strategic Communication. Mumbai: John Wiley & Sons, Inc.; 2018.
12. Kumar, V.K.R., Patil, A.B., dan Karnalli, A.P. Validation and Various Qualifications in HVAC System – A Review from Pharmaceutical Quality Assurance Prospect. International Journal of Pharmaceutical Quality Assurance. 2018;9(3):281-286.
13. McWilliam, J. Review of Airflow Measurement Techniques. Belgia: AIVC; 2003.
14. Mohan, R.S.R., dan Gupta, V. Qualification of tunnel Sterilizing Machine. International Journal of PharmTech Research. 2016;9(3):400-405.
15. PDA. Technical Report No.61: Steam in Place task Force Members. PDA Journal of Pharmaceutical Science and Technology; 2007.
16. PDA. Validation of Moist Heat Sterilization Processes: Cycle Design, Development, Qualification and Ongoing Control. PDA Journal of Pharmaceutical Science and Technology; 2007
17. PDA. Steam Sterilization and the 2007 Revision of PDA Technical Report 1. PDA Journal of Pharmaceutical Science and Technology; 2007.
18. PDA. Technical Report No.48 Moist Heat Sterilizer Systems: Design, Commissioning, Operation, Qualification, and Maintanance. PDA Journal of Pharmaceutical Science and Technology; 2022.
19. Prajapati, S., Agari, N., Patil, S. An Overview of Validation and Comparison of HVAC System at Rest and in Operation in Pharmaceutical Industry. Journal of Pharma Innovation. 2022;2(2): 24-32
20. Sabale, S., Thorat, S. An Overview on Validation Process in Pharmaceutical Industries. Scholars Academic Journal of Pharmacy. 2021;10(6):95-101.
21. Sadrizadeh, S., Aganovic,A., Bogdan, A., Wang, C., Afshari, A., et al. A systematic review of operating room ventilation. Journal of Building Engineering. 2021;40:1-15.
22. Sharma, A., Anup, N., dan Tekade, R.K. Achieving Sterility in Biomedical and Pharmaceutical Product (part-1): Thermal, Chemical, and Filtration Sterilization. The Future of Pharmaceutical Product Development and Research. ; 2020
23. Sheaffer, G., dan Warrier, K. Validation of Dry Heat Sterilization and Depyrogenation. Agallaco, J. (Ed.). Handbook of Validation in Pharmaceutical Processes. Boca Raton: CRC Press; 2021
24. Shinde, S.J., Jain, P.S., Kale, N.K. Critical Review on Qualification of Sterilization Equipment in Aseptic Processing. Journal of Pharmaceutical and BioSciences. 2014;1:24-35.
25. Shukla, A.K. et al. A Risk Assessment Approach: Qualification of a HVAC System in Aseptic Processing Area Using Building Management System. Quality Assurance Journal. 2011;14:40-49.
26. Siagian, R.C., dan Ayuningtyas, D. Gap analysis for drug development policy making: An attempt to close the gap between policy and its implementation. PLOS ONE. 2019;14(8):1-13.
27. Singh, A., Malviya, S., dan Kharia, A. Demand of Pharmaceutical Facility Functionality: Validation and Qualification of HVAC System. Asian Journal of Pharmaceutics. 2014;125-129.
28. Singh, H., et al. Execution & Qualification of Heating, Ventilation and Air Conditioning System. Journal of Pharmaceutical Research & Education. 2016;1(1):172-195.
29. Tabasevic, H., dan Milanovic, D.D. Research of The Scope of Testing Required for Qualification of The HVAC System. International Quality Conference Quality Research. 2019;13:553-562.
30. Talekar, A.R., dan Pise, A.G. Systematic Approach of autoclave Qualification: A Review. International Journal of Medical & Pharmaceutical Sciences. 2023;13(9):1-6.
31. Tamilselvan, N., Umamaheswari, A., Prabu, S.L.. Revolutionizing The Major Threat Challenges in Pharmaceutical Industries by Monitoring Heating, Ventilation and Air Conditioning Systems. Environment Academy of Sciences and Arts of The Republic of Srpska. 2023;203-241
32. WHO. TRS 1010-Annex 8: Guidelines on heating, ventilation and air-conditioning systems for non-sterile pharmaceutical products. WHO Technical Series; 2018.
cara mengutip artikel
https://jurnal.unpad.ac.id/farmasetika/rt/captureCite/56399/23504
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3