Majalah Farmasetika, 8 (5) 2023, 447-458
https://doi.org/10.24198/mfarmasetika.v8i5.47193
Artikel Penelitian
Rizky Indah Febrianingsih Suddin Putri*1, Holis Abdul Holik2
1Program Studi Profesi Apoteker, Fakultas Farmasi, Universitas Padjadjaran
2Departemen Analisis Farmasi dan Kimia Medisinal, Fakultas Farmasi, Universitas Padjadjaran
Jl. Raya Bandung Sumedang KM. 21 Jatinangor, Jawa Barat, Indonesia
*E-mail: rizky18013@mail.unpad.ac.id
(Submit 31/05/2023, Revisi 07/06/2023, Diterima 26/06/2023, Terbit 18/07/2023)
Abstrak
Industri farmasi memegang penuh tanggung jawab terhadap mutu dari produk yang dihasilkannya. Mutu produk harus dijaga sejak awal hingga akhir proses produksi sehingga konsumen mendapatkan produk yang aman, efektif, dan sesuai khasiatnya. Untuk meninjau suatu proses produksi dapat konsisten menghasilkan produk yang memenuhi spesifikasi, dilakukan Product Quality Review (PQR) dengan melihat indeks kapabilitas (Cpk). Penelitian ini bertujuan untuk mengetahui pengendalian mutu dari sediaan ampul asam traneksamat 100 mg pada industri farmasi di Jawa Barat dengan menganalisis kapabilitas proses serta menggali upaya peningkatan kualitas dengan metode six sigma melalui 5 tahapan analisa DMAIC (Define, Measure, Analyze, Improve, dan Control). Hasil penelitian menunjukkan nilai Cpk < 1,33. Hal ini menandakan bahwa indeks kapabilitas proses masih belum memadai, dan didapatkan variasi mutu pada proses masih lebar. Rekomendasi yang dapat dilakukan dalam meningkatkan mutu proses diantaranya meningkatkan kemampuan personil dengan pelatihan, serta meninjau kembali metode yang digunakan pada tahap analisis kadar dan produksi.
Kata kunci: DMAIC, Kapabilitas Proses, Indeks Kapabilitas
Teks Lengkap:
Pendahuluan
Mutu dari suatu produk merupakan hal fundamental yang keberadaannya wajib terjamin sesuai spesifikasi. Mutu produk berupa obat ditentukan sejak lini awal produksi diantaranya bahan awal, lingkungan, perlengkapan manufaktur, dan pemahaman teknis yang tersirat selama pengembangan dan pembuatan obat (1). Tujuan membangun mutu dalam produk obat adalah untuk membantu memastikan bahwa setiap obat yang sampai ke pasien berupa obat yang aman, efektif, dan sesuai mutunya (1). Aspek mutu dan siklus hidup produk dapat ditinjau dengan Product Quality Review (PQR) yang berfungsi sebagai alat untuk proses verifikasi yang berkesinambungan jika dilakukan secara teratur karena akan memberikan jaminan konsistensi proses pembuatan produk (2). Menurut CPOB 2018, pengkajian mutu produk hendaklah dilakukan secara berkala terhadap seluruh obat-obatan yang telah terdaftar (3). PQR dilakukan setiap tahunnya terhadap masing-masing produk untuk menilai standar kualitas dengan tujuan memverifikasi konsistensi proses dan untuk memeriksa kelayakan dari spesifikasi saat ini (4).
PQR dirancang dengan tujuan untuk memverifikasi konsistensi proses pembuatan yang dilakukan, memverifikasi kesesuaian spesifikasi bahan awal dan produk jadi, menyoroti tren kualitas yang merugikan dan mengidentifikasi peningkatan produk dan proses (5). Dalam PQR terdapat penggunaan kapabilitas proses sebagai alat untuk mengidentifikasi variasi yang melekat dalam proses (2). Data-data yang termuat dalam laporan PQR meliputi proses produksi (In Process Control) serta hasil pengujian dari bagian Quality Control, parameter In Process Control dibuat menjadi studi indeks kapabilitas (6).
Kapabilitas proses banyak digunakan sebagai sarana dalam menentukan apakah suatu proses mampu menghasilkan produk sesuai spesifikasi dan dalam toleransi tertentu (7). Parameter kapabilitas proses dapat mencerminkan konsistensi suatu proses dalam memenuhi spesifikasi yang telah ditetapkan dan menilai seberapa baik kapabilitas proses (8,9). Spesifikasi merupakan kriteria yang ditetapkan sebagai standar mutu yang wajib dipenuhi oleh zat obat maupun produk obat agar dapat diterima sebagaimana tujuan penggunaannya (10). Kisaran maksimum parameter mutu yang dapat diterima disebut batas spesifikasi. Jika parameter ditemukan di luar rentang ini, produk tidak dapat dijual atau tidak berfungsi dan harus diklasifikasikan sebagai produk yang tidak memenuhi syarat. Setelah menetapkan nilai target spesifikasi, batas spesifikasi dapat berupa batas atas (Upper Spesification Limit), dan bawah (Lower Spesification Limit), atau bahkan hanya satu sisi atas atau bawah (11).
Setelah USL dan LSL telah ditentukan, maka nilai kapabilitas proses dapat dihitung. Terdapat beberapa kapabilitas proses, diantaranya Cp (Capability) dan CpK (Capability Index). Cp hanya menghubungkan kemampuan proses dengan rentang spesifikasi, dengan interpretasi nilai Cp melebihi 1,33 menunjukkan bahwa proses tersebut cukup memenuhi spesifikasi, nilai Cp diantara 1,33 dan 1,00 menunjukkan bahwa proses tersebut cukup untuk memenuhi spesifikasi namun memerlukan pengendalian yang
ketat, sedangkan nilai Cp dibawah 1,00 menunjukkan proses tidak mampu memenuhi spesifikasi (12). Sedangkan nilai Cpk mempertimbangkan rata-rata proses, mengukur lokasi proses dan mengevaluasi penyebaran proses, Cpk diinterpretasi dengan nilai yang lebih besar dari 1,33 menunjukkan bahwa suatu proses memadai dalam jangka pendek. Nilai kurang dari 1,33 menyatakan bahwa variasi terlalu lebar dibandingkan dengan spesifikasi (12). Perhitungan nilai Cp dan Cpk dihitung menggunakan rumus (12) :
Cp = (USL-LSL)/6SD
Cpk = min { (USL-X)/3SD, (X-LSL)/3SD}
Keterangan :
Cp : Capability
CpK : Capability Index
USL : Upper Spesification Limit
LSL : Lower Spesification Limit
X : Nilai Rata-rata
SD : Standar Deviasi
Nilai Cpk dapat ditingkatkan dengan perbaikan proses menggunakan metodologi Six Sigma DMAIC. Six Sigma DMAIC merupakan benchmark untuk memeriksa proses atau kualitas produk, serta memiliki kemampuan untuk meningkatkan efisiensi dan kualitas produk (13). Penggunaan metode DMAIC semakin populer dalam proses yang tidak hanya terkait dengan produksi dan manufaktur, tetapi juga, IT, kesehatan, dan banyak lainnya (14). Metodologi ini menggunakan struktur untuk analisis dan diagnosis masalah (15). Tahapan DMAIC yaitu define, measure, analyse, improvement, dan control (16).
Penjagaan mutu produk dengan memperhatikan kemampuan proses berjalan konsisten perlu dilakukan terlebih khusus dalam pembuatan sediaan steril, dengan tujuan memastikan konsumen mendapatkan produk yang aman, efektif, dan sesuai khasiatnya. Tahapan kritis dalam proses produksi sediaan ampul terdapat pada tahap mixing dan sterilisasi akhir, maka dari itu perlu dianalisis kapabilitas proses pada tahap tersebut untuk melihat konsistensi proses produksi dan dilakukan upaya peningkatkan kualitas dengan analisis menggunakan metode DMAIC six sigma. Berdasarkan latar belakang tersebut, penelitian ini bertujuan untuk menganalisis dan mengevaluasi kapabilitas proses sediaan ampul asam traneksamat 100 mg yang diproduksi selama tahun 2022 di salah satu industri farmasi di Jawa Barat.
Metode
Penelitian bersifat kuantitatif dengan menggunakan data yang dikumpulkan dari hasil pemeriksaan pada parameter kadar produk jadi ampul asam traneksamat 100 mg dari departemen Quality Control yang meliputi pengujian in process control (IPC) terhadap dua parameter aspek proses yaitu tahapan pencampuran (mixing) dan sterilisasi akhir selama periode Januari hingga Desember 2022. Kumpulan data dianalisis menggunakan software Microsoft excel untuk dihitung nilai Cp (Capability) serta Cpk (Capability Index). Kemudian dilakukan studi kapabilitas untuk meningkatkan nilai kapabilitas proses dan meminimalisir kemungkinan faktor-faktor yang dapat mempengaruhi rendahnya nilai Cpk. Metode studi kapabilitas yang digunakan adalah metode Six Sigma dengan 5 tahapan analisa DMAIC (Define, Measure, Analyze, Improve, dan Control).

Gambar 1 Tahapan DMAIC (17)
Hasil
Dilakukan pengumpulan data untuk seluruh parameter kimia yang dilakukan pada produk ampul asam traneksamat 100 mg dengan periode produksi Januari-Desember 2022. Berdasarkan rekapan batch yang telah dikumpulkan, diambil 11 batch yang dilakukan analisis dengan pertimbangan kelengkapan data yang dimiliki. Dari batch tersebut dilakukan analisis terhadap parameter kimia dari departemen QC. Perhitungan kapabilitas dilakukan terhadap pengujian kadar baik tahap mixing maupun sterilisasi akhir. Data diolah, kemudian dibandingkan dengan spesifikasi awal produk yang ditinjau dari nilai USL dan LSL untuk mengategorikan hasil data ke dalam kategori memenuhi syarat (MS) atau tidak memenuhi syarat (TMS). Nilai USL dan LSL terhadap suatu produk dapat berbeda di setiap industrinya, menyesuaikan dengan kebijakan masing-masing industri. Hasil pemeriksaan kadar ampul Asam Traneksamat pada tahapan mixing dan sterilisasi akhir tercantum dalam Tabel 1.
Tabel 1. Data Kadar Ampul Asam Traneksamat 100 mg
| No. Batch | x̄ Kadar Mixing (%) | x̄ Kadar Sterilisasi Akhir (%) |
| 1 | 98,357 | 100,569 |
| 2 | 100,528 | 100,939 |
| 3 | 101,966 | 98,642 |
| 4 | 99,783 | 100,697 |
| 5 | 100,769 | 100,263 |
| 6 | 99,797 | 101,087 |
| 7 | 100,502 | 101,464 |
| 8 | 99,756 | 99,034 |
| 9 | 100,195 | 101,119 |
| 10 | 99,709 | 100,299 |
| 11 | 99,976 | 99,893 |
| x̄ | 100,122 | 100,364 |
| SD | 0,841 | 0,886 |
| USL (%) | 105 | 105 |
| LSL (%) | 97 | 97 |
| Cp | 1,586 | 1,505 |
| Cpk (u) | 1,934 | 1,744 |
| Cpk (l) | 1,238 | 1,266 |
Keterangan:
x̄ = Rata-rata
SD = Standar Deviasi
USL = Upper Spesification Limit
LSL = Lower Spesification Limit
Cp = Capability
Cpk (u) = Capability Index dengan nilai USL (Upper Specification Limit)
Cpk (l) = Capability Index dengan nilai LSL (Lower Specification Limit)
Berdasarkan hasil analisis kapabilitas proses, didapatkan hasil sebaran data berupa kadar rata-rata terdapat diantara rentang USL dan LSL, maka dari itu proses dapat disimpulkan terkendali. Nilai Cp untuk tahap mixing dan sterilisasi akhir berturut-turut adalah 1,586 dan 1,505, hal ini menunjukkan nilai Cp > 1,33 yang berarti bahwa kapabilitas proses memadai. Sedangkan nilai Cpk untuk tahap mixing dan sterilisasi akhir secara berturut-turut adalah 1,238 dan 1,266 yang menandakan bahwa kapabilitas proses belum memadai, kapabilitas proses memadai ditandai dengan nilai Cpk > 1,33. Hal ini disebabkan ditemukannya variasi yang terlalu lebar terhadap nilai rata-rata kadar. Variasi yang terlalu lebar tersebut berada mendekati batas spesifikasi yang memungkinkan terjadinya cacat produk pada saat proses produksi, namun hal ini dapat diatasi dengan meningkatkan kualitas proses sehingga tidak terdapat sebaran data yang mendekati nilai USL dan LSL.
Pembahasan
1. Tahap Define
Pada tahap ini dilakukan identifikasi terkait faktor yang menjadi kemungkinan penyebab terjadinya penurunan kapabilitas suatu proses. Salah satu faktor penyebab yaitu hasil pengujian dengan batch yang memiliki nilai kadar yang cukup jauh dibandingkan nilai rata-rata kadar pada masing-masing tahapan proses, hal ini menyebabkan terdapat variasi yang lebar dan berakibat terhadap nilai Cpk yang rendah. Kemampuan proses yang dikategorikan baik terjadi jika penyebaran variasi sesuai dengan batas yang ditentukan (18). Terdapatnya nilai dengan variasi lebar dapat diakibatkan penyimpangan pada proses produksi, sehingga tidak didapatkan hasil yang konsisten.
2. Tahap Measure
Tahap measure dilakukan dengan menganalisa, dan menghitung nilai kapabilitas proses dengan menghitung nilai Cpk pada tahap mixing dan sterilisasi akhir. Pada analisis kapabilitas proses, tidak terdapat nilai kadar yang berada diluar spesifikasi, baik batas atas maupun bawah. Hal ini menandakan bahwa proses terkendali. Hasil diluar spesifikasi dapat muncul diakibatkan penyimpangan dalam proses pembuatan produk, kesalahan prosedur pengujian, atau karena tidak berfungsinya peralatan analitis (19). Spesifikasi yang tidak terpenuhi dengan baik berpotensi menimbulkan masalah serius bagi industri seperti biaya yang berlebihan, kualitas produk yang rendah, dan lamanya waktu pemasaran (20).
Kapabilitas proses mengevaluasi kinerja proses terkait, dan diterapkan untuk meningkatkan kinerja pengendalian proses (21). Berdasarkan hasil analisis kapabilitas proses pada tahap mixing, terdapat batch yang memiliki variasi cukup lebar dibandingkan nilai rata-rata kadar seluruh batch (100,122%) yaitu pada batch pertama dengan nilai 98,357% dan batch ketiga dengan nilai 101,966.
Sedangkan pada tahap sterilisasi akhir, terdapat tiga batch yang memiliki variasi cukup lebar terhadap nilai rata-rata kadar seluruh batch (100,364%), yaitu pada batch ketiga (98,642%), ketujuh (101,464%), dan kedelapan (99,034%). Jika ditelaah kembali, hasil tersebut masih berada dalam rentang batas spesifikasi atas dan bawah, namun dengan adanya variasi nilai yang cukup lebar, maka akan berpengaruh terhadap nilai standar deviasi yang didapatkan. Pengukuran indeks kapabilitas proses (Cpk) bergantung pada standar deviasi proses (22). Nilai Standar Deviasi berbanding terbalik dengan nilai Cpk. Maka dari itu semakin besar nilai standar deviasi maka nilai indeks kapabilitas akan semakin kecil.
3. Tahap Analyze
Tahap analisis bertujuan untuk penentuan dan penyelesaian suatu penyebab. Metode identifikasi masalah yang digunakan adalah Ishikawa Diagram atau Fishbone Diagram. Studi ini menyarankan diagram tulang ikan untuk analisis teknologi (23). Analisis dilakukan dengan menggunakan 5 kategori yaitu Man, Methods, Machines, Materials, dan Environment (24). Dikarenakan akar penyebab yang ditemukan mungkin tidak terbatas, maka dari itu diagram ini membantu dalam mengidentifikasi akar penyebab dengan cara yang terstruktur dan tepat (25). Salah satu faktor yang dapat menjadi penyebab adanya penyimpangan pada suatu proses produksi dan analisis yaitu terletak pada peran personil. Banyak industri farmasi gagal mengidentifikasi pentingnya dan perlunya program pelatihan berkualitas bagi personil sehingga menyebabkan kurangnya pengembangan tingkat keterampilan personil (26). Maka dari itu pelatihan personil secara berkelanjutan dan berkala sangat penting dilakukan. Selain itu, terdapat kemungkinan terjadinya kesalahan di laboratorium seperti ketika pelaksanaan metode analisis, penggunaan standar yang salah, dan/atau kesalahan saat perhitungan data. Maka dari itu harus dilakukan investigasi untuk mengidentifikasi penyebab Out of Specification (OOS) (27).
Kapabilitas proses yang belum memadai dianalisis akar penyebabnya dengan menggunakan diagram Ishikawa. Didapatkan hasil sebagaimana tercantum dalam Gambar 1.
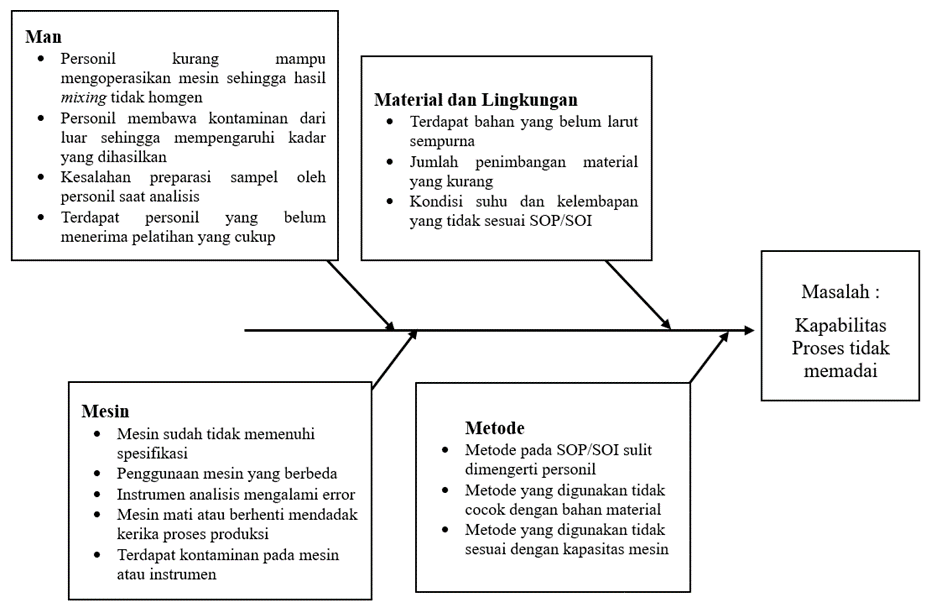
Gambar 2 Diagram Ishikawa
Selain hal-hal yang memungkinkan terjadinya permasalahan dari 5 kategori tersebut, penting adanya tahapan validasi kembali untuk memastikan bahwa semua tahapan proses sudah sesuai. Validasi meliputi validasi metode analitik, validasi proses, validasi pembersihan dan validasi peralatan (28).
4. Tahap Improve
Pada tahap ini, dilakukan kerja sama tim untuk mengatasi akar penyebab dan membuat perubahan yang bertujuan untuk menghilangkan masalah yang menyebabkan variabilitas dalam proses (29). Hasil dari analisis tahapan analyze akan digunakan dalam usulan perbaikan untuk proses produksi kedepannya. Pada kasus ini terdapat beberapa usulan yang digunakan guna meningkatkan kemampuan kapabilitas proses diantaranya :
1)Man : dilakukan pelatihan kembali termasuk pengoperasian mesin dan instrumen serta cara penanganan bahan maupun sampel analisa steril.
2)Material dan lingkungan : Memilih material yang mudah larut, untuk sediaan injeksi sehingga larut sempurna, termasuk menganalisis kualitas vendor bahan baku. Melakukan pelaporan jika suhu maupun kelembapan ruang produksi tidak sesuai SOP/SOI.
3) Mesin : Menandai mesin-mesin yang membutuhkan kualifikasi atau validasi ulang,
dan segera melakukan perbaikan. Melakukan validasi pembersihan dengan ketat
4) Metode : Memeriksa kembali SOP/SOI yang digunakan dan memastikan tidak
terdapat kalimat yang ambigu atau sulit dimengerti, menelaah kembali
Manufacturing Batch Record (MBR) dan menyesuaikan dengan kapasitas mesin
yang tersedia.
5. Tahap Control
Tahap control adalah fase terakhir dari metodologi DMAIC Six Sigma dan berisi aktivitas untuk memastikan bahwa peningkatan dari suatu analisis dapat dipertahankan. Hal ini mencakup pemantauan proses, analisis hasil dan tindakan korektif yang sesuai bila diperlukan untuk mempertahankan proses dalam kondisi sentral atau stabil (30).
Tahapan control dilakukan dengan perbaikan dan peninjauan secara berkala terhadap aspek-aspek yang dapat memengaruhi kapabilitas proses. akhir yang dapat dilakukan yaitu control dengan peninjauan secara berkala terhadap perbaikan yang dilakukan. Beberapa tindakan yang dapat dijadikan sebagai Tindakan pengendalian diantaranya melakukan pelatihan untuk personil secara rutin dan terjadwal, melakukan double check pada setiap tahapan analisa kadar, dan memantau kondisi material, reagen, dan baku pembanding secara rutin.
Kesimpulan
Berdasarkan hasil pengkajian data terhadap kapabilitas proses ampul asam traneksamat, didapatkan perolehan nilai Cpk untuk tahap mixing dan sterilisasi akhir secara berturut-turut adalah 1,238 dan 1,266. Nilai Cpk < 1,33 menandakan bahwa indeks kapabilitas proses masih belum memadai, dan proses penjagaan mutu dari sediaan ampul asam traneksamat 100 mg pada industri tersebut perlu ditingkatkan. Berdasarkan analisis dengan DMAIC six sigma, beberapa faktor yang dapat ditingkatkan agar indeks kapabilitas meningkat diantaranya faktor personil, mesin, material dan lingkungan serta metode. Faktor personil memegang peranan terbesar dalam hal ini, maka dari itu diperlukan pelatihan secara berkala untuk meningkatkan kemampuan personil dan dipertimbakan kembali pada metode analisis kadar dan produksi agar mudah dipahami oleh personil.
Daftar Pustaka
1. Goyal P, Gupta V. Building Quality in Pharmaceutical Products. Int J Res Publ Rev. 2021;2(12):1610–3.
2. Zubair M. Product Quality Reviews and Its Importance in Product Lifecycle. 2022;11(3):5–11.
3. BPOM RI. Peraturan Badan Pengawas Obat dan Makanan No 34 Tahun 2018 Tentang Cara Pembuatan Obat yang Baik. BPOM RI. Jakarta; 2018.
4. Vora K, Shah J, Maheshwari D, Affairs P. Comparitive Evaluation Of Annual Product Quality Review With Respect To Us And Europe. Int J Recent Sci Res. 2015;6(4):3336–3341.
5. Australian Government Department of Health Therapeutic Goods Administration. Product Quality Reviews (PQRs) for listed and complementary medicines Technical guidance on the interpretation of the PIC/S Guide to GMP. 2019. 10–14 p.
6. Inggriani AS, Husni P. Artikel Tinjauan : Product Quality Review Sebagai Evaluasi Mutu Produk. Farmaka. 2018;16(1):113–8.
7. Wooluru Y, Swamy DR, Nagesh P. Process Capability Assessment with Trended Processes : A Case Study Process Capability Assessment with Trended Processes : A Case Study. Int J Stat Econ. 2015;16(3):69–80.
8. Vugigi S, Mshila C, Ogaji I. Use of Product Quality Review to Evaluate Quality and Process Capability: A Case Study of Ibuprofen in a Model Tablet Manufacture. East Cent African J Pharm Sci. 2021;24.
9. Mahapatra A, Song J, Shao Z, Dong T, Gong Z, Paul B. Concept Of Process Capability Indices as A Tool For Process Performance Measures And Its Pharmaceutical Application. J Drug Deliv Ther. 2020;10(5):333–44.
10. Nurhayati, Hasanah AN. Analisis Kapabilitas Proses Produksi Sediaan Drop dengan Menggunakan Program Statistik Minitab. Maj Farmasetika. 2022;7(4):325.
11. Zappa BD. Lower and Upper Specification Limits ( LSL , USL ). 2016;1–2.
12. Wooluru Y, Swamy DR, Nagesh P. The process capability analysis – A tool for process performance measures and metrics – A case study. Int J Qual Res. 2014;8(3):399–416.
13. Gupta V, Jain R, Meena ML, Dangayach GS. Six-sigma application in tire-manufacturing company: a case study. J Ind Eng Int. 2018;14(3):511–20.
14. Nowotarski P, Szymanski P, Rzepecka P. DMAIC Method of Quality Improvement of Ground Works Processes: Case Study. IOP Conf Ser Earth Environ Sci. 2019;221(1).
15. Rahman A, Shaju SUC, Sarkar SKM, Hashem Z, Hasan SKR, Mandal R. A Case Study of Six Sigma Define-Measure-Analyze-Improve-Control (DMAIC) Methodology in Garment Sector. Indep J Manag Prod. 2018;8(4):1309–23.
16. Bhargava M, Gaur S. Process Improvement Using Six-Sigma (DMAIC Process) in Bearing Manufacturing Industry: A Case Study. IOP Conf Ser Mater Sci Eng. 2021;1017(1).
17. Patil AB, Inamdar KH. Process Improvement using DMAIC Approach: Case Study in Downtime Reduction. Int J Eng Res Technol [Internet]. 2014;3(3):1930–4. Available from: https://www.ijert.org/research/process-improvement-using-dmaic-approach-case-study-in-downtime-reduction-IJERTV3IS031609.pdf
18. Rimantho D, Athiyah. Analisis Kapabilitas Proses Untuk Pengendalian Kualitas Air Limbah di Industri Farmasi. J Teknol. 2019;11(1):1–8.
19. Kumar KA, Vishal Gupta N. Handling of out of specification results. Int J Pharm Qual Assur. 2015;6(2):38–44.
20. Morosini M, Borsato M. An approach for the generation of target product specifications in the development of home appliances. 2018;(April).
21. Arcidiacono G, Nuzzi S. A review of the fundamentals on process capability, process performance, and process sigma, and an introduction to Process Sigma Split. Int J Appl Eng Res. 2017;12(14):4556–70.
22. Álvarez E, Moya-Férnandez PJ, Blanco-Encomienda FJ, Muñoz JF. Methodological insights for industrial quality control management: The impact of various estimators of the standard deviation on the process capability index. J King Saud Univ – Sci. 2015;27(3):271–7.
23. Coccia M. The Fishbone diagram to identify, systematize and analyze the sources. J Soc Adm Sci. 2017;4(4):291–303.
24. Liliana L. A new model of Ishikawa diagram for quality assessment. IOP Conf Ser Mater Sci Eng. 2016;161(1).
25. Shinde D, Ahirrao S, Prasad R. Fishbone Diagram: Application to Identify the Root Causes of Student–Staff Problems in Technical Education. Wirel Pers Commun. 2018;100:653–64.
26. Pai DR, Kamath K, Subramanyam EVS, Shabaraya AR. Personnel training for pharmaceutical industry. Int J Pharm Qual Assur. 2016;7(3):55–61.
27. S N RK, M. P. G, V. GH, Ravi G. Management of Out of Specification (OOS) for Finished Product. Int J Pharm Clin Res. 2017;9(3):221–32.
28. Jindal D, Kaur H, Patil RK, Patil HC. Validation – In pharmaceutical industry: Equipment validation: A brief review. Adesh Univ J Med Sci Res. 2020;2(2):94–8.
29. Monday LM. Define, Measure, Analyze, Improve, Control (DMAIC) Methodology as a Roadmap in Quality Improvement. Glob J Qual Saf Healthc. 2022;5(2):44–6.
30. Singh BJ, Khanduja D. Perspectives of control phase to manage Six Sigma implements: An empirical study. Int J Bus Excell. 2014;7(1):88–111.
cara mengutip artikel ini
https://jurnal.unpad.ac.id/farmasetika/rt/captureCite/47193/0
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3