Majalah Farmasetika, 7 (4) 2022, 325-406 https://doi.org/10.24198/mfarmasetika.v7i5.39510
Artikel Penelitian
Download PDF
Nurhayati*1, Aliya NurHasanah,2
1Program Studi Profesi Apoteker, Fakultas Farmasi, Universitas Padjadjaran
2Departemen Analisis Farmasi dan Kimia Medisinal, Fakultas Farmasi, Universitas Padjadjaran Jl. Raya Bandung Sumedang KM. 21 Jatinangor, Jawa Barat, Indonesia
*Email: nurhayati17001@mail.unpad.ac.id
(Submit 07/05/2022, Revisi 29/05/2022, Diterima 31/05/2022, Terbit 04/06/2022)
Abstrak
Nilai rasio kapabilitas proses produksi merupakan salah satu output dari kegiatan pengkajian mutu produk sebagai bagian dari kegiatan sistem mutu industri farmasi untuk memastikan seluruh produk farmasi termasuk produk ekspor yang diedarkan di masyarakat memiliki konsistensi dari segi keamanan, khasiat dan mutu. Tujuan penelitian ini adalah untuk menunjukkan hasil evalausi kemampuan proses produksi sediaan larutan tetes oral yang diproduksi secara rutin selama tahun 2019-2020 di salah satu industri farmasi di Bandung, Jawa Barat, Indonesia. Penelitian ini merupakan penelitian kuantitatif dengan menganalisis rasio kemampuan proses (Cpk) berdasarkan nilai hasil pengujian yang diperoleh pada saat evaluasi proses produksi dan nilai spesifikasi yang telah ditetapkan oleh industri menggunakan program analisis statistik Minitab 19.1. Penelitian ini menganalisis 3 parameter proses produksi dan 5 parameter evaluasi pengujian kimia produk. Berdasarkan hasil analisis tersebut menunjukkan terdapat 2 parameter pengujian yang memiliki nilai Cpk tidak kapabel (≤ 1,33) yaitu parameter persentase hasil pengisian dengan nilai Cpk -0,54 dan persentase hasil produk jadi dengan nilai Cpk -0,48. Hasil ini menunjukkan bahwa proses pengisian dan hasil akhir produk jadi tidak menunjukkan konsistensi yang cukup baik sehingga kedua proses tersebut harus dilakukan investigasi secara mendalam agar tidak mempengaruhi pemenuhan mutu proses pengisian kegiatan produksi di tahun berikutnya.
Kata Kunci
pengkajian mutu produk, kapabilitas proses, rasio Cpk, Minitab
Pendahuluan
Industri farmasi adalah badan usaha yang memiliki izin sesuai dengan ketentuan peraturan perundang-undangan. Industri farmasi dikontrol dan diawasi secara berkala oleh Pemerintah dan Badan Pengawas Obat dan Makanan (BPOM) baik dalam perizinan pendirian industri, proses produksi, kualitas produk dan perizinan edar produk (1). Hal ini dilakukan untuk menghasilkan produk yang memenuhi standar mutu, khasiat dan keamanan dari segi proses pembuatan, pendistribusian hingga penyerahan obat ke tangan konsumen sampai pada akhirnya obat tersebut dikonsumsi oleh pasien (2). Oleh sebab itu, BPOM membuat suatu aturan terkait segala proses industri farmasi di dalam Peraturan Badan Pengawas Obat dan Makanan No 34 Tahun 2018 Tentang Cara Pembuatan Obat yang Baik (CPOB). Salah satu aspek yang harus dipenuhi oleh industri farmasi di seluruh Indonesia untuk mendapatkan sertifikat CPOB ini adalah memenuhi aspek sistem mutu industri farmasi. Di dalam aspek tersebut menjelaskan bahwa totalitas semua pengaturan yang dibuat adalah dengan tujuan untuk memastikan bahwa obat memiliki mutu yang sesuai dengan tujuan penggunaan selama masa siklus hidupnya (3–5).
Industri farmasi terus dituntut untuk dapat mempertahankan kualitas produknya agar tetap memenuhi standar yang telah ditentukan. Evaluasi kualitas produk dilakukan untuk mengetahui apakah standar yang dibutuhkan oleh konsumen telah terpenuhi. Salah satu cara yang dapat digunakan untuk melakukan evaluasi terhadap kualitas produk yaitu dengan melakukan kegiatan pengkajian mutu produk. Pengkajian mutu produk yaitu evaluasi yang dilakukan terhadap semua obat terdaftar termasuk produk ekspor (3). Tujuan dilakukannya pengkajian mutu produk yaitu untuk memverifikasi konsistensi proses produksi suatu produk, menentukan kualitas dan cacat proses dari produk, memungkinkan perbaikan dari metode dan proses yang cacat, menentukan tren dari yield, hasil analisis dan parameter produksi, meninjau kualitas bahan baku dan bahan kemas dari produk, menentukan stabilitas produk dan meninjau CAPA (Corrective Action dan Preventive Action) serta dampaknya terhadap mutu produk (6).
Kegiatan pengkajian mutu produk ini harus dilakukan secara berkala tiap tahun untuk seluruh batch produksi produk farmasi yang diproduksi pada tahun tersebut dan didokumentasikan dengan tetap mempertimbangkan hasil kajian ulang sebelumnya untuk menjaga kualitas proses produksi yang menjamin kemanan dan khasiat produk di suatu industri farmasi (3). Pengkajian mutu produk ini dilakukan dengan cara mengumpulkan hasil evaluasi data seluruh batch produk yang diproduksi selama satu tahun dan membuat tren grafik yang dapat membantu menentukan kesalahan dan kemungkinan diperlukannya perbaikan metode dan proses produksi (3,7).
Dalam pengkajian mutu produk ini menghasilkan salah satu parameter kritis yaitu nilai rasio kemampuan proses atau kapabilitas proses (Cpk) yang membandingkan antara output produk dengan spesifikasi produk. Nilai Cpk adalah nilai yang menunjukkan posisi dari proses yang terjadi terhadap batas spesifikasi bawah (LSL) dan batas spesifikasi atas (USL) dari produk yang diukur dengan mempertimbangkan presisi dan akurasi. Nilai Cpk yang baik adalah bernilai ≥1.33. Apabila nilai Cpk yang dimiliki oleh produk bernilai di bawah 1,33 maka dapat dikatakan bahwa proses yang dialami oleh produk tersebut bermasalah karena tidak sesuai dengan batas spesifikasi yang telah ditentukan. Sebaliknya, apabila nilai Cpk telah berada di atas 1,33 maka proses yang dialami oleh produk tersebut telah sesuai dengan batas spesifikasinya (8).
Secara standar nilai rasio Cp dan Cpk dapat dihitung dengan rumus sebagai berikut: (7,9)
Jika parameter yang mempunyai 2 batas spesifikasi:

Parameter ini memberikan penilaian seberapa konsisten proses memenuhi spesifikasi yang telah ditentukan dan seberapa baik kapabilitas proses (10,11). Spesifikasi adalah standar mutu kritis yang menetapkan berbagai kriteria yang harus dipenuhi oleh zat obat atau produk obat agar dianggap dapat diterima untuk tujuan penggunaannya. Spesifikasi diusulkan dan ditetapkan oleh industri farmasi dan disetujui oleh pihak berwenang sebagai syarat persetujuan (12).
Oleh sebab itu, pentingnya dilakukan evaluasi produk untuk seluruh produk obat yang diproduksi di industri farmasi, melatarbelakangi penelitian ini dilakukan. Penelitian ini bertujuan untuk menunjukkan hasil evalausi kemampuan proses berdasarkan nilai rasio kapabilitas proses produksi (Cpk) khususnya untuk sediaan larutan tetes oral dengan zat aktif setirizin dihidroklorida yang diproduksi pada tahun 2019-2020 di salah satu industri farmasi di Bandung. Diharapkan dari pengkajian mutu produk ini dapat diketahui konsistensi proses produksi sediaan larutan tetes oral tersebut dalam memenuhi spesifikasi yang telah ditentukan (3).
Metode
Penelitian ini adalah penelitian kuantitatif yang dilaksanakan dengan cara mengumpulkan data dari bagian produksi, pengawasan mutu dan pemastian mutu yang terdiri dari dokumen spesifikasi, dokumen metode pengujian, Catatan Pengolahan Batch (CPB) sediaan larutan tetes oral dengan zat aktif setirizin dihidroklorida pada tahun 2019-2020, dokumen Persetujuan Nomor Izin Edar, Laporan validasi proses, laporan uji stabilitas, dan laporan pengujian yang masih berlaku pada saat produksi produk tersebut. Parameter spesifikasi proses produksi yang dianalisis diambil dari 3 parameter aspek proses produksi yang meliputi persentase hasil pencampuran, persentase hasil pengisian dan persentase hasil produk jadi. Selain itu dianalisis juga 5 parameter dari aspek hasil evaluasi pengujian kimia yang meliputi parameter bobot jenis, pH, volume terpindahkan, persentase kadar natrium benzoat sebagai pengawet dan presentase kadar setirizin dihidroklorida sebagai bahan aktif utama dalam produk ini.
Data yang terkumpul kemudian dilakukan analisis dengan membuat tren grafik masing- masing parameter menggunakan software Microsoft excel dan dilanjutkan analisis nilai Cp dan Cpk menggunakan program analisis statistik Minitab 19.1. Analisis statistik dilakukan dengan menggunakan sigma 3 karena terbatasnya kemampuan mesin dan pekerja di industri farmasi tersebut. Sigma ini memiliki tingkat kepercayaan 99,73% untuk suatu analisis yang tidak terlalu ketat batasan spesifikasinya (13,14). Data hasil Cp dan Cpk diinterpretasikan berdasarkan kategori nilai sebagai berikut:
Tabel 1 Interpretasi hasil Cp dan Cpk

Hasil
Dalam penelitian ini, bagian pemastian mutu Industri farmasi tersebut telah menetapkan Jumlah batch produksi yang dianalisis setiap tahunnya adalah minimal 10 batch produksi. Jika dalam waktu satu tahun tidak memenuhi sejumlah batch produksi tersebut, maka pengkajian mutu produk dapat ditunda untuk menganalisis seluruh batch produksi produk selama dua tahun dan seterusnya. Hal ini karena jumlah data yang dianalisis akan mempengaruhi keakurasian hasil yang diperoleh. Data yang digunakan dalam penelitian ini adalah data hasil analisis proses produksi dan evaluasi pengujian kimia dari proses produksi sediaan larutan tetes oral yang mengandung zat aktif setirizin dihidroklorida selama periode Januari 2019 – Desember 2020 dengan jumlah sediaan larutan tetes oral adalah sebanyak 12 batch dengan rincian datanya tercantum dalam Tabel 2 dan Tabel 3 berikut ini:
Tabel 2 Hasil Analisis Pengujian Paremeter Proses Produksi

*) Persentase hasil tidak memenuhi syarat (TMS) Cp dan Cpk ≤ 1,33 = Tidak Kapabel
Cp dan Cpk ≥ 1,33 = Kapabel
P-Value >0,05 = Terdistribusi Normal
P-Value <0,05 = Tidak Terdistribusi Normal
Data ini dilakukan analisis menggunakan program statistik Minitab 19.1 dan didapat histogram grafik seperti pada Lampiran 1.


Dari hasil analisis pengujian parameter proses produksi, presentasi hasil pencampuran memiliki data seluruhnya memenuhi syarat dengan batas spesifikasi bawahnya adalah 90% dan dari hasil analisis Process Capability Index (PCI) memiliki nilai rasio Cpk 25,47 menunjukkan bahwa proses kapabel. Tetapi untuk parameter presentase hasil pengisian memiliki 8 data yang tidak memenuhi syarat dan presentase hasil produk jadi memiliki 7 data yang tidak memenuhi syarat dengan rentang batas spesifikasi 98-100%. Sehingga data yang tidak memenuhi syarat ini mempengaruhi hasil rasio Cpk dengan hasil rasio Cpk negatif yang menunjukkan bahwa proses tidak kapabel.
Tabel 3 Hasil Analisis Evaluasi Pengujian Kimia

Cp dan Cpk ≤ 1,33 = Tidak Kapabel Cp dan Cpk ≥ 1,33 = Kapabel
P-Value > 0,05 = Terdistribusi Normal
P-Value < 0,05 = Tidak Terdistribusi Normal
Data ini dilakukan analisis menggunakan program statistik Minitab 19.1 dan didapat histogram grafik seperti pada Lampiran 2.



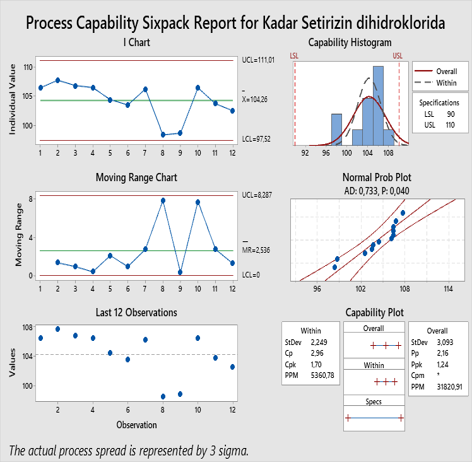

Hasil analisis evaluasi pengujian kimia tersebut menunjukkan bahwa semua data dari masing-masing parameter yang meliputi bobot jenis, pH, volume terpindahkan, kadar zat aktif (setirizin dihidroklorida) dan kadar pengawet (natrium benzoat) memenuhi syarat yang dibuktikan dengan nilai rasio Cpk ≥ 1,33 dengan rentang batas spesifikasinya yaitu untuk bobot jenis 1,08-1,20; pH 4,0-6,0; volume terpindahkan tidak kurang dari 100% volume yang tertera pada etiket (10 mL), presentase kadar setirizin dihidroklorida 90-110%, dan presentase kadar natrium benzoat 80-120%. Sehingga data ini menunjukkan bahwa proses produksi menghasilkan sifat kimia produk yang memenuhi syarat dan proses dinyatakan kapabel.
Pembahasan
Analisis Pengujian Proses Produksi
Proses produksi dapat dipengaruhi oleh beberapa faktor yaitu personalia, mesin, peralatan dan ketepatan prosedur selama proses produksi. Penelitian ini menganalisis tiga parameter penting dari proses produksi sediaan larutan tetes oral yaitu proses pencampuran bahan, proses pengisian ke dalam kemasan primer dan hasil produk jadi yang disesuaikan dengan jumlah teoritis pada batch record. Analisis rasio kapabilitas proses terhadap hasil pengujian proses produksi ini, dilakukan untuk mengetahui konsistensi suatu operasional produksi di industri farmasi dalam mempertahankan kualitas dan mutu produk selama proses produksi sehingga dapat memperkirakan variasi output dari proses, mempermudah pengembangan pemilihan proses produksi, menentukan pemilihan mesin, dan membantu program pengendalian kualitas sehingga dapat meminimalisasi penambahan biaya produksi (2,15).
Nurhayati, Majalah Farmasetika, 7 (4) 2022, 325-406
Dari hasil analisis tiga parameter proses produksi tersebut, menunjukkan bahwa presentase hasil proses pencampuran menunjukkan data uji normalitas tidak terdistribusi normal dengan nilai P-value adalah <0,005. Hal ini disebabkan karena rentang variasi data tidak jauh berbeda. Uji normalitas ini tidak mempengaruhi hasil statistik karena variasi data yang ada masih memenuhi persyaratan penerimaan. Hal ini dapat dilihat berdasarkan hasil analisis Process Capability Index (PCI) didapatkan nilai Cpk sebesar 25,47. Secara statistik kapabilitas proses menunjukkan bahwa proses tersebut sangat kapabel (Cpk > 3,00) sehingga secara keseluruhan parameter persentase hasil pencampuran ini menunjukkan bahwa proses produksi berjalan dengan baik dan penyimpangan jarang terjadi pada saat proses pencampuran di produksi.
Namun, parameter persentase hasil pengisian dan produk jadi memiliki data yang berada diluar batas spesifikasi dengan nilai rasio Cpk persentase hasil pengisian adalah
-0,54 dan persentase hasil produk jadi memiliki rasio Cpk -0,48. Hasil Cpk yang negatif
menunjukkan variasi data pengujian banyak yang berada diluar batas spesifikasi (16). Sehingga secara statistik kapabilitas proses menunjukkan bahwa proses tidak kapabel dan berdampak pada tidak terpenuhinya aspek mutu produk (17). Berdasarkan investigasi yang telah dilakukan melalui catatan batch record, persentase hasil pengisian tidak memenuhi syarat karena mesin pengisian produk larutan tetes oral yang digunakan dalam proses produksi masih bersifat semi-manual, sehingga terjadi ketidak stabilan proses pengisian yang menyebabkan volume pengisian ke dalam botol sediaan larutan tetes oral, banyak yang mendekati volume atas. Sehingga hasil presentase mendekati batas spesifikasi bawah karena jumlah hasil pengisian ke kemasan primer menjadi lebih sedikit dan tidak sesuai dengan perhitungan teoritis yang tercantum di dalam batch record.
Presentase hasil produk jadi juga memiliki nilai kapabilitas proses yang tidak kapabel karena dampak dari proses pengisian sebelumnya yang tidak memenuhi syarat (TMS) sehingga jumlah produk sediaan larutan tetes oral yang dihasilkan tidak konsisten di setiap batch produksinya dan menyimpang dari jumlah teoritis yang telah ditetapkan. Kedua proses ini dapat dilakukan evaluasi salah satunya menggunakan form CAPA atau diagram fishbones untuk menentukan akar masalah penyebab ketidak konsistensian proses pengisian selama produksi agar tidak mempengaruhi kualitas mutu proses produksi dan jumlah produk jadi yang dihasilkan (8).
Evaluasi Pengujian Kimia Produk
Evaluasi pengujian kimia ini dimaksudkan untuk mengetahui konsistensi industri farmasi dalam mempertahankan keamanan dan khasiat suatu produk. Jenis parameter yang diuji ditetapkan oleh kebijakan dari masing-masing industri farmasi (3). Parameter yang dianalisis dalam evaluasi pengujian kimia ini meliputi bobot jenis, pH, volume terpindahkan, kadar setirizin dihidroklorida, dan kadar natrium benzoat. Parameter- parameter ini juga penting untuk dievaluasi dalam proses pengkajian mutu produk terutama analisis parameter kadar zat aktif agar tetap sesuai dengan tujuan efikasinya. Parameter ini sangat kritis karena jika kadar zat aktif tidak dapat dipertahankan jumlahnya selama proses produksi, maka efek terapetiknya akan berkurang atau akan menimbulkan efek yang tidak diinginkan untuk penggunaannya (18).
Dari hasil pengujian pada Tabel 3 menunjukkan bahwa semua data parameter evaluasi pengujian kimia berada diantara batas spesifikasi yang dipersyaratkan. Berdasarkan hasil analisis Process Capability Index (PCI), nilai rasio kapabilitas proses masing- masing parameter pengujian menunjukkan data yang memenuhi syarat dan secara statistik dinyatakan bahwa proses tersebut sangat kapabel (> 3,00) dengan nilai rasio Cpk bobot jenis yaitu 6,74; nilai Cpk parameter pH 6,67; dan nilai rasio Cpk parameter volume terpindahkan 4,71.
Parameter presentase kadar setirizin dihidroklorida dan presentase kadar natrium benzoat memiliki nilai rasio kapabilitas proses yang mendekati batas bawah yang dipersyaratkan dengan nilai rasio Cpk presentase kadar setirizin dihidroklorida yaitu 1,70 dan nilai rasio Cpk presentase kadar natrium benzoat yaitu 2,74. Meski nilai ini tidak sebesar hasil rasio kapabilitas parameter pengujian kimia lainnya, Namun nilai ini menunjukkan proses bersifat kapabel karena masih memenuhi batas rentang nilai keberterimaan kapabilitas proses yaitu ≥ 1,33 (19). Sehingga dari hasil tren grafik dan pengujian kapabilitas proses seluruh parameter evaluasi pengujian kimia menunjukkan bahwa industri farmasi mampu mempertahankan kualitas khasiat dan keamanan sediaan produknya dengan baik.
Kesimpulan
Hasil rasio kapabilitas proses dari 3 aspek parameter proses produksi dan 5 aspek evaluasi pengujian kimia terdapat 2 parameter proses produksi yang tidak kapabel yaitu parameter persentase hasil pengisian dan persentase hasil produk jadi dengan nilai Cpk yaitu -0,54 dan -0,48 (≤ 1,33). Hal ini menunjukkan bahwa proses pengisian dan hasil akhir produk jadi tidak menunjukkan konsistensi yang cukup baik. Meskipun seluruh parameter evaluasi pengujian kimia yang mewakili keamanan dan khasiat produk memenuhi syarat, namun kedua proses tersebut harus dilakukan investigasi secara mendalam agar tidak mempengaruhi pemenuhan mutu proses pengisian kegiatan produksi di tahun berikutnya, salah satunya dengan membuat analisis CAPA atau diagram fishbones untuk menetapkan akar masalah.
Daftar Pustaka
- BPOM. Peraturan Badan Pengawas Obat dan Makanan Nomor 26 Tahun 2018 Tentang Pelayanan Perizinan Berusaha Terintegrasi Secara Elektronik Sektor Obat Dan Makanan. Jakarta: BPOM; 2018.
- Amalia T. Tanggung Jawab Industri Farmasi Terhadap Penerapan Aturan Pemerintah Tentang CPOB. Jurnal Inkofar. 2018;1(1):59–67.
- BPOM. Peraturan Badan Pengawas Obat dan Makanan No 34 Tahun 2018 Tentang Cara Pembuatan Obat yang Baik. Jakarta: BPOM; 2018
- International Council for Harmonisation. ICH guideline Q10 on Pharmaceutical Quality System. Eur Med Agency. 2015;44:1–20. Available from: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/ 09/WC500002871.pdf
- PIC/S. Guide To Good Manufacturing Practice for Medicinal Products Part 1. Vol. 15. 2021. 1–143.
- Australian Government Department of Health Therapeutic Goods Administration. Product Quality Reviews (PQRS) For Listed And Complementary Medicines Technical Guidance On The Interpretation of The PIC/S Guide to GMP. Australia: Australian Government Department of Health Therapeutic Goods Administration; 2019. 10–14 p.
- Sanjeevaiah N, Munaga S. Annual Product Quality Review: Guidance for Industry by Regulatory Perspective. International Journal of Medical Research. 2017;2(4):1– 10.
- Hendrawan E, Susanto HV, Susanto SAJ, Rahardjo B. Analisa Kapabilitas Proses untuk Proses Injeksi dan Blow Moulding. Jurnal Rekayasa Sistem Industri. 2017;4(01):16.
- Dong P, Wang YB, Peng DZ, Wang JJ, Cheng YT, Deng XY, et al. Utility of Process Capability Indices In Assessment of Quality Control Processes at A Clinical Laboratory Chain. Journal of Clinical Laboratorium Analysis. 2021;35(8):1–8.
- Vugigi S, Mshila C, Ogaji I. Use of Product Quality Review to Evaluate Quality and Process Capability: A Case Study of Ibuprofen in a Model Tablet Manufacture. Vol. 24, East and Central African Journal of Pharmaceutical Sciences. 2021.
- Mahapatra APK, Song J, Shao Z, Dong T, Gong Z, Paul B, et al. Concept Of Process Capability Indices as A Tool For Process Performance Measures And Its Pharmaceutical Application. Journal of Drug Delivery and Therapeutics. 2020;10(5):333–44.
- ICH. ICH Topic Q 6 A Specifications: Test Procedures and Acceptance Criteria for New Drug Substances and New Drug Products: Chemical Substances. Vol. 375, EMEA. 2000. 1753 p.
- Alashaari Galal Abdulqader Ahmed. The Process Capability To Fulfill Specifications With An Application In Pharmaceutical Tablets Weights. International Journal of Advanced Applied Sciences. 2021 Feb 1;8(2):70–6.
- Arcidiacono G, Nuzzi S. A Review Of The Fundamentals on Process Capability, Process Performance, And Process Sigma, And An Introduction To Process Sigma Split. International Journal Applied Engineering Research. 2017;12(14):4556–70.
- Vora KM, Shah J, Maheshwari D. Annual Product Quality Review : Regulatory Aspect. Journal of Global Trends Pharmaceutical Sciences. 2015;6(1):2345–50.
- Rimantho D, Athiyah. Analisis Kapabilitas Proses Untuk Pengendalian Kualitas Air Limbah di Industri Farmasi. Jurnal Teknologi. 2019;11(1):1–8.
- Sangshetti JN, Deshpande M, Zaheer Z, Shinde DB, Arote R. Quality by design Approach: Regulatory Need. Arabian Journal of Chemistry. 2017;10:S3412–25. Available from: http://dx.doi.org/10.1016/j.arabjc.2014.01.025.
- Badan POM. Peraturan Kepala Badan POM No.17 tahun 2015 tentang Pedoman Penilaian Produk Biosimilar. Jakarta: BPOM; 2015. 1–34.
- Wooluru Y, D.R S, Nagesh P. The Process Capability Analysis – A Tool For Process Performance Measures and Metrics – A Case Study. International Journal of Quality Research. 2014;8(3):399–416.
Cara mengutip artikel ini
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3



