Majalah Farmasetika, 8 (5) 2023, 424-446
https://doi.org/10.24198/mfarmasetika.v8i5.46906
Artikel Review
Christina Damayanti1*, Aliya Nur Hasanah2
1Program Studi Profesi Apoteker, Fakultas Farmasi, Universitas Padjadjaran, Jatinangor 45363
2Departemen Analisis Farmasi dan Kimia Medisinal, Fakultas Farmasi, Universitas Padjadjaran, Jatinangor 45363
*E-mail: christina18001@mail.unpad.ac.id
(Submit 18/05/2023, Revisi 23/05/2023, Diterima 11/06/2023, Terbit 18/07/2023)
Abstrak
Kontaminasi silang dapat mempengaruhi mutu dan keamanan produk yang diproduksi oleh industri farmasi. Metode FMEA (Failure Modes and Effects Analysis) merupakan metode yang dapat digunakan untuk menilai risiko terjadinya kontaminasi silang. Penilaian risiko ini dilakukan dengan tahapan identifikasi risiko, analisis risiko, dan evaluasi risiko yang menggunakan pengkategorian berdasarkan Risk Priority Number (RPN). Berdasarkan hal tersebut, dilakukan penelitian berupa penilaian risiko kontaminasi silang pada area produksi pada salah satu industri farmasi di DKI Jakarta. Penelitian ini menunjukkan 38 risiko dengan kategori berdasarkan RPN yaitu rendah, sedang, tinggi, dan sangat tinggidari keseluruhan proses produksi. Nilai RPN terendah sebesar ≤30 dan tertinggi sebesar ≥150. Berdasarkan nilai tersebut, didapatkan risiko dengan nilai RPN 30-60 (sedang), 75-100 (tinggi), dan lebih dari 150 (sangat tinggi) yang menjadi prioritas untuk menentukan tindakan pengendalian terhadap risiko yang telah teridentifikasi. Oleh karena itu, industri farmasi tersebut dapat segera menentukan dan melaksanakan tindakan pengendalian untuk mengurangi risiko keberulangan kontaminasi silang, seperti teknik pembersihan yang dimodifikasi serta pembungkusan peralatan kotor dan peralatan bersih yang tidak dilakukan. Tindakan pengendalian dapat dilakukan dengan pelatihan personil, perbaikan SOP, serta peningkatan fasilitas pembersihan sehingga mutu produk yang diproduksi tetap terjaga.
Kata kunci: Industri Farmasi, Kontaminasi Silang, Penilaian Risiko
Teks Lengkap:
Pendahuluan
Kontaminasi silang dapat terjadi pada proses produksi obat-obatan di Industri Farmasi. Kontaminasi silang adalah suatu proses yang terjadi ketika bahan awal atau produk tercemar oleh bahan atau produk lainnya yang menyebabkan kecampurbauran (1,2). Kontaminasi silang dapat mempengaruhi mutu dan keamanan produk yang diproduksi oleh industri farmasi. Bahkan, kontaminasi silang dalam obat-obatan dapat berdampak serius hingga diperlukan penarikan produk (3,4). Pada tahun 2018, FDA melaporkan terdapat 27% kasus penarikan terkait kontaminasi silang (5). Oleh karena itu, industri farmasi perlu untuk meminimalkan risiko terjadinya kontaminasi silang selama proses produksi sesuai dengan tujuan dari Cara Pembuatan Obat yang Baik (CPOB) (6). Salah satu contoh kasus kontaminasi silang yang dapat ditemukan yaitu kontaminasi silang produk penisilin terhadap produk non-beta-laktam. Kejadian ini ditemukan sebanyak 103 kali pada tahun 2017, 44 kali pada tahun 2018, dan 9 kali pada tahun 2019 di industri farmasi dimana ditemukan sekitar 10% konsumen yang mengalami reaksi tidak diinginkan terhadap penisilin dan reaksi alergi serius yang dapat berdampak fatal (7,8).
Risiko merupakan kemungkinan yang tidak pasti terkait kejadian buruk yang tidak terduga dan tidak diinginkan dimana dapat mengancam pencapaian suatu tujuan. Dalam bidang farmasi, risiko terkait dengan hampir semua proses yang dilakukan dan produk yang diproduksi di industri farmasi, seperti risiko kontaminasi silang (9,10). Risiko terjadinya kontaminasi silang dapat diminimalisir dengan cara industri farmasi melaksanakan pembersihan yang baik dan tervalidasi (11). Maka dari itu, manajemen risiko mutu dapat dilakukan untuk mengetahui risiko kontaminasi silang, terutama dalam pelaksanaan pembersihan, yang terjadi di industri farmasi (12). Manajemen risiko mutu merupakan suatu proses yang dilakukan secara sistematis dalam menilai, mengendalikan, mengkomunikasi, serta mengkaji risiko yang berdampak pada mutu suatu produk dalam sepanjang life-cycle produk tersebut (13).
Pendekatan manajemen risiko yang efektif dapat memastikan kualitas tinggi dari produk obat dengan identifikasi dan pengendalian potensi masalah kualitas secara proaktif selama proses pengembangan dan pembuatan produk obat. Manajemen risiko mutu ini dapat membantu dalam pengambilan keputusan ketika masalah terkait kualitas muncul, seperti ketercampurbauran, kontaminasi, dan kontaminasi silang dalam proses produksi (14). Sebagai contoh berdasarkan penelitian Alsaidalani dan Elmadhoun (15), manajemen risiko mutu dapat membantu pengambilan keputusan terhadap kontaminasi produk akibat kurangnya pembersihan botol kaca produk steril. Oleh karena itu, ditentukan keputusan untuk perbaikan SOP terkait daftar periksa pembersihan botol kaca tersebut.
Salah satu bagian dari manajemen risiko mutu adalah penilaian risiko. Penilaian risiko dalam industri farmasi berperan penting untuk dapat mengetahui hal-hal yang dapat mempengaruhi mutu produk (15). Selain itu, penilaian risiko digunakan untuk
meningkatkan pemahaman proses dan memberikan produk yang aman dan efektif kepada pasien (16). Penilaian risiko mencakup idenfitikasi, analisis, dan evaluasi bahaya/kegagalan yang dapat disebabkan oleh suatu risiko dengan melakukan identifikasi risiko, analisis risiko, dan evaluasi risiko (17). Penilaian risiko dapat dilakukan dengan berbagai metode, seperti metode dasar dengan diagram alir, Fault Tree Analysis (FTA), Hazard Analysis and Critical Control Points (HACCP), Hazard & Operability Analysis (HAZOP), Preliminary Hazard Analysis (PHA), Failure Modes and Effects Analysis (FMEA), Risk Ranking & Filtering, dan statistik pendukung (17).
Salah satu metode yang sering digunakan di industri farmasi yaitu FMEA. FMEA merupakan suatu metode yang memiliki tujuan untuk penilaian risiko kegagalan dalam proses dan identifikasi bagian paling penting untuk pengembangan. Risiko yang dapat dinilai dengan metode ini merupakan risiko tinggi terkait parameter kritis dari proses produksi beserta peralatan dan fasilitasnya (17,18). FMEA memprioritaskan potensi kegagalan menurut risiko, probabilitas, dan kemungkinan deteksi untuk mengimplementasikan tindakan perbaikan. Metode FMEA memiliki kelebihan dalam memperhitungkan risiko dan tingkat keparahannya (19,20). Penilaian risiko dengan FMEA memanfaatkan risk priority number (RPN) dimana hasil analisisnya dapat membantu dalam identifikasi dan perbaikan mode kegagalan (21). Berdasarkan uraian tersebut, penelitian terkait penilaian risiko di salah satu industri farmasi di DKI Jakarta ini dilakukan untuk menilai risiko kontaminasi silang pada proses pembersihan peralatan di area produksi meliputi proses identifikasi, analisis, dan evaluasi potensial risiko.
Metode
Penelitian ini dilakukan secara observasional di salah satu industri farmasi di DKI Jakarta. Penelitian terkait penilaian risiko kontaminasi silang dilakukan observasi secara langsung di area produksi seperti pada Gambar 1.

Gambar 1. Area Produksi untuk Observasi
Penelitian ini dilakukan dengan mengamati kesesuaian pelaksanaan pembersihan peralatan dengan SOP yang mencakup alur personil (operator yang melaksanakan proses produksi dan cleaner yang melaksanakan pembersihan peralatan) dan alur peralatan seperti pada Gambar 2-4.

Gambar 2. Alur Operator dalam Pembersihan Peralatan

Gambar 3. Alur Cleaner dalam Pembersihan Peralatan

Gambar 4. Alur Peralatan dalam Proses Pembersihan
Penilaian risiko dalam penelitian ini dilakukan dengan mencakup tahapan sebagai berikut:
1.Identifikasi risiko
2.Analisis risiko dilakukan menggunakan metode pemberian skor berdasarkan tingkat keparahan, kejadian, dan deteksi Keparahan Tingkat keparahan dapat dilakukan pemberian skor berdasarkan Tabel 1.
Tabel 1. Kategori Tingkat Keparahan

-Kejadian tingkat kemungkinan kejadian dapat ditentukan berdasarkan Tabel 2.
Tabel 2. Kategori Tingkat Kejadian

-Deteksi dapat dinilai untuk menentukan kemampuan mendeteksi risiko dengan pemberian skor seperti pada Tabel 3.
Tabel 3. Kategori Tingkat Deteksi

3. Evaluasi risiko dilakukan dengan menentukan Risk Priority Number (RPN) untuk
memprioritaskan mode kegagalan yang akan ditentukan tindakan korektifnya (22).
RPN dapat diperoleh dengan rumus RPN = kejadian x keparahan x deteksi (23).
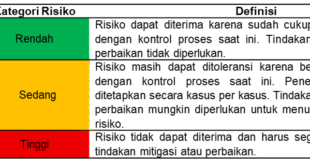
Berdasarkan hasil RPN yang didapatkan, risiko digolongkan berdasarkan kriterianya
menjadi rendah, sedang, tinggi, dan sangat tinggi.seperti pada Tabel 4.
Tabel 4. Kategori Risk Priority Number

Selain itu, penelitian ini juga dilakukan berdasarkan wawancara kepada operator dan cleaner terkait “Bagaimana cara melakukan pembersihan sehari-hari?” kemudian disesuaikan dengan prosedur yang tertera di SOP untuk mengkonfirmasi terkait hasil observasi yang didapatkan.
Hasil
Hasil penilaian risiko dilakukan di area produksi yang mencakup area penimbangan, granulasi, pentabletan, penyalutan, pengisian kapsul, produksi produk nasal, dan pengemasan primer.
Tabel 5. Risiko di Area Penimbangan

Berdasarkan hasil, ditemukan tiga risiko di area penimbangan (Tabel 5) dengan satu risiko kategori sangat tinggi dan satu risiko kategori tinggi yang memerlukan tindakan perbaikan.
Tabel 6. Risiko di Area Granulasi



Berdasarkan hasil, ditemukan sembilan risiko di area granulasi (Tabel 6) dengan tiga risiko kategori sangat tinggi, tiga risiko kategori tinggi, dan dua risiko kategori sedang yang memerlukan tindakan perbaikan.
Tabel 7. Analisis Risiko di Area Pentabletan


Berdasarkan hasil, ditemukan lima risiko di area pentabletan (Tabel 7) dengan dua risiko kategori sangat tinggi, dua risiko kategori tinggi, dan satu risiko kategori sedang yang memerlukan tindakan perbaikan.
Tabel 8. Risiko di Area Penyalutan





Berdasarkan hasil, ditemukan sebelas risiko di area penyalutan (Tabel 8) dengan tujuh risiko kategori sangat tinggi, dua risiko kategori tinggi, dan satu risiko kategori sedang yang memerlukan tindakan perbaikan.
Tabel 9. Risiko di Area Pengisian Kapsul

Berdasarkan hasil, ditemukan satu risiko di area pengisian kapsul (Tabel 9) dengan risiko kategori sedang yang memerlukan tindakan perbaikan.
Tabel 10. Risiko di Area Produksi Produk Nasal



Berdasarkan hasil, ditemukan enam risiko di area produksi produk nasal (Tabel 10) dengan risiko kategori sangat tinggi yang memerlukan tindakan perbaikan.
Tabel 11. Risiko di Area Pengemasan Primer


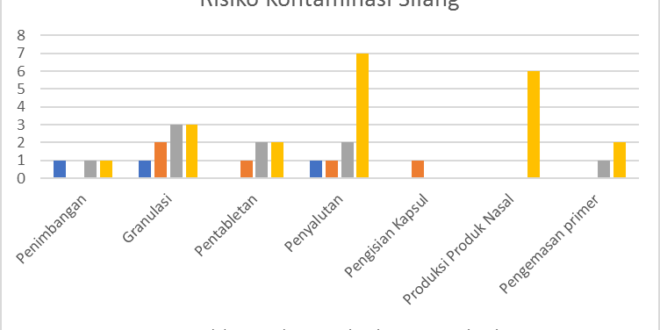
Berdasarkan hasil, ditemukan tiga risiko di area pengemasan primer (Tabel 11) dengan dua risiko kategori sangat tinggi dan satu risiko kategori tinggi yang memerlukan tindakan perbaikan. Berdasarkan Tabel 1-7, didapatkan sebanyak 38 risiko dari keseluruhan proses produksi selanjutnya dibuat grafik risiko kontaminasi silang berdasarkan kategorinya pada setiap proses produksi seperti tercantum dalam Gambar 5.

Gambar 5. Grafik Risiko Kontaminasi Silang
Pembahasan
Industri farmasi berupaya dalam meningkatkan keselamatan pasien yang mengonsumsi obatnya melalui manajemen risiko mutu. Bagian utama dalam manajemen risiko mutu adalah penilaian risiko (24). Proses penilaian risiko harus menjawab beberapa pertanyaan, seperti “apa yang salah?”, “apa probabilitasnya”, “apa konsekuensi untuk kualitas produk?”, “kegagalan apa yang dapat dideteksi dan bagaimana caranya?” (25). Penilaian risiko kontaminasi silang terkait pembersihan peralatan yang dilakukan di salah satu industri farmasi di DKI Jakarta dilaksanakan melalui tahapan identifikasi risiko terlebih dahulu. Dalam menentukan identifikasi risiko, memunculkan pertanyaaan “apa yang mungkin terjadi?” (26). Tahapan ini melibatkan penggunaan informasi yang dikumpulkan untuk menunjukkan bahaya ketika penilaian risiko sedang dilakukan (27). Risiko diidentifikasi melalui berdasarkan tahapan yang mewakilkan proses produksi yaitu dari proses penimbangan hingga pengemasan primer. Setelah risiko diidentifikasi, dilakukan analisis risiko untuk memahami dampak negatifnya dan kemungkinan dampak yang mungkin terjadi (28). Analisis risiko dilakukan menggunakan metode FMEA dengan memperhatikan tingkat keparahan, kejadian, dan deteksi (29,30). Setelah risiko dianalisis, dilakukan evaluasi risiko menggunakan RPN.
Berdasarkan hasil penelitian yang didapatkan, ditemukan berbagai kategori risiko yang berpotensi beberapa diantaranya adalah kategori sedang, tinggi, dan sangat tinggi. Ketiga kategori tersebut merupakan risiko yang memiliki nilai RPN tinggi sehingga menjadi prioritas untuk menentukan tindakan pengendalian terhadap risiko yang telah teridentifikasi (31). Selain itu berdasarkan hasil penilaian risiko yang didapatkan, diketahui terdapat risiko yang sama antar satu proses produksi dengan proses lainnya, seperti teknik pembersihan yang dimodifikasi serta pembungkusan yang tidak dilakukan pada peralatan kotor dan peralatan bersih. Maka, diperoleh bahwa kegiatan yang menyebabkan kontaminasi silang sering terjadi secara berulang. Keberulangan kontaminasi silang tersebut dapat disebabkan kurangnya pemahaman dan kesadaran terkait pelaksanaan pembersihan peralatan. Oleh karena itu, risiko kontaminasi silang tersebut perlu dikendalikan untuk menjaga mutu produk. Tindakan yang dapat diambil atas risiko tersebut yakni menghilangkan risiko dan mengurangi risiko ke tingkatan yang dapat diterima atau menerima risiko (32). Dalam menghilangkan atau mengurangi risiko kontaminasi silang ini, penulis menyarankan industri farmasi untuk melaksanakan pelatihan personil dalam meningkatkan pemahaman personil terkait teknik pembersihan peralatan dalam mencegah keberulangan. Selain itu, dapat dilakukan perbaikan SOP sebagai pedoman terkait pembersihan peralatan yang belum dijelaskan sebelumnya. Selain itu, dapat dilakukan pula peningkatan fasilitas pembersihan sehingga pembersihan peralatan dapat lebih maksimal.
Kesimpulan
Berdasarkan penilaian risiko kontaminasi silang yang telah dilakukan di area produksi di salah satu industri farmasi di DKI Jakarta, dapat disimpulkan bahwa risiko yang teridentifikasi sejumlah 38 risiko yang mencakup kategori rendah, sedang, tinggi, dan sangat tinggi pada proses pembersihan peralatan di area penimbangan, granulasi, pentabletan, penyalutan, pengisian kapsul, produksi produk nasal, dan pengemasan primer. Berdasarkan risiko yang diperoleh tersebut, risiko yang diprioritaskan dalam tindakan pengendalian yaitu risiko dengan nilai RPN 30-60 (sedang), 75-100 (tinggi), dan lebih dari 150 (sangat tinggi). Oleh karena itu, industri farmasi tersebut dapat segera menentukan dan melaksanakan tindakan pengendalian untuk risiko dengan kategori sedang, tinggi, dan sangat tinggi untuk mengurangi risiko terjadinya kontaminasi silang sehingga mutu produk yang diproduksi tetap terjaga.
Daftar Pustaka
1. Mathia E. Pharmaceutical product cross-contamination: industrial and clinical
pharmacy practice. Dar Es Salaam Med Students’ J. 2013;19(2):17–9.
2. BPOM RI. Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 34 Tahun 2018 Tentang Cara Pembuatan Obat yang Baik. BPOM RI. 2018. 70–73 p.
3. Sargent E V., Flueckiger A, Barle EL, Luo W, Molnar LR, Sandhu R, et al. The regulatory framework for preventing cross-contamination of pharmaceutical products: History and considerations for the future [Internet]. 2016. Available from: https://www.sciencedirect.com/science/article/abs/pii/S0273230016301428
4. BPOM RI. Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 14 Tahun 2022 Tentang Penarikan Dan Pemusnahan Obat Yang Tidak Memenuhi Standar Dan/Atau Persyaratan Keamanan, Khasiat, Mutu, Dan Label. 2022.
5. United States Food and Drug Administration. REPORT ON THE STATE OF PHARMACEUTICAL QUALITY [Internet]. 2018 [cited 2023 May 15]. Available from: https://www.fda.gov/media/125001/download
6. Khaira N, Megantara S. Review: Validasi Pembersihan (Cleaning Validation). Farmaka. 2020;18(2):115–21.
7. United States Food and Drug Administration. WARNING LETTER: Deva Holding AS – Cerkezkoy Subesi [Internet]. 2019 [cited 2023 May 15]. Available from: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/deva-holding-577493-cerkezkoy-subesi
8. Centers for Disease Control and Prevention. Evaluation and Diagnosis of Penicillin Allergy for Healthcare Professionals [Internet]. 2017 [cited 2023 May 15]. Available from: https://www.cdc.gov/antibiotic-use/clinicians/Penicillin-Allergy.html
9. Pangestuti DC, Nastiti H, Husniaty R. Failure mode and effect analysis (FMEA) for mitigation of operational risk. Inovasi. 2021;17(3):593–602.
10. World Health Organization. Annex 2 WHO guidelines on quality risk management.
11. Singh K, Tamta B, Mukopadayay S. Cleaning validation process in pharmaceutical industry. Int J Health Sci (Qassim). 2022;6(April):13557–73.
12. WHO. Annex 2. Points to consider when including Health-Based Exposure Limits (HBELs) in cleaning validation. Appendix 1 Using Health-Based Exposure Limits (HBELs) to assess risk in cleaning validation. WHO Expert Comm Specif Pharm Prep WHO Tech Rep Ser 1033. 2021;94–109.
13. Khan AS, Khan F, Rao N. Quality Risk Management in Pharmaceutical Industries. Int J Res Pharm Chem. 2020;10(2):215–23.
14. Khristi A, Khristi P. A REVIEW ON “ FAILURE MODE AND EFFECTS ANALYSIS – A TOOL OF QUALITY RISK MANAGEMENT ” BASED ON ICH Q9 Elecon Engineering Co . Ltd ., Anand Sojitra Road ,. Int J Res Pharm Chem. 2018;8(1):33–43.
15. Alsaidalani R, Elmadhoun B. Quality Risk Management in Pharmaceutical Manufacturing Operations: Case Study for Sterile Product Filling and Final Product Handling Stage. Sustain. 2022;14(15).
16. Mollah AH, Baseman HS, Long M, Mollah AH, Baseman HS, Long M, et al. A Practical Discussion of Risk Management for Manufacturing of Pharmaceutical Products A Practical Discussion of Risk Management for. 2014;
17. Vijayakumar Reddy V, Vishal Gupta N, Raghunandan H V., Nitin Kashyap U. Quality risk management in pharmaceutical industry: A review. Int J PharmTech Res. 2014;6(3):908–14.
18. Cardoso P, Flávia M, Kelen S. Risk Analysis Evaluation of Piroxicam 20Mg Capsules Manufacture Process By Fmea Technique. Int J Drug Regul Aff. 2018;6(1):19–25.
19. Vázquez-valencia A, Santiago-sáez A. Colombian Journal of Anesthesiology Usefulness of failure mode and effects analysis for improving mobilization safety in critically ill patients Utilidad de análisis modal de fallos y efectos para mejorar la seguridad en el movilización del paciente. 2018;46(1):3–10.
20. Ismael OA, Ahmed MI. Using quality risk management in pharmaceutical industries: A case study. Qual – Access to Success. 2020;21(178):106–13.
21. Nuchpho P, Nansaarng S, Pongpullponsak A. Risk Assessment in the organization by using FMEA Innovation: A Literature Review. Proc 7th Int Conf Educ Reform. 2014;(March):781–9.
22. Wu J, Tian J, Zhao T. Failure mode prioritization by improved RPN calculation method. Proc – Annu Reliab Maintainab Symp. 2014;(January).
23. Wu X, Wu J. The Risk Priority Number Evaluation of FMEA Analysis Based on Random Uncertainty and Fuzzy Uncertainty. Complexity. 2021;2021.
24. Mandhare TA, Khuspe PR, Nangare PS, Vyavhare RD. Quality Risk Management : A Review. 2018;8(March).
25. Delivery D, Mv L. QUALITY RISK MANAGEMENT ( QRM ): A REVIEW. J Drug Deliv Ther. 2013;3(2):149–54.
26. Kaya GK, Ward JR, John Clarkson P. A framework to support risk assessment in hospitals. Int J Qual Heal Care. 2019;31(5):393–401.
27. Sumukha Krishna P, Gangadharappa H V., Nagendra S, Hemanth Kumar S. An overview of risk management and risk-based cleaning validatio. Int J Res Pharm Sci. 2020;11(4):5407–14.
28. Al-Amari AA. Risk Analysis , Assessment , and Management in Social Research : A New Approach in Research Project Management. J Posit Sch Psychol. 2022;6(4):3207–16.
29. Zuniawan A. A Systematic Literature Review of Failure Mode and Effect Analysis (FMEA) Implementation in Industries. IJIEM – Indones J Ind Eng Manag. 2020;1(2):59.
30. U. S. Food and Drug Administration. Guidance for Industry: Q9 Quality Risk Management. Food Drug Adm [Internet]. 2006;9(May):1–72. Available from: http://www.fda.gov/cder/guidance/index.htmhttp://www.fda.gov/cber/guidelines.htm.%0Ahttp://www.fda.gov/cder/guidance/index.htmhttp://www.fda.gov/cber/guidelines.htm.%0Ahttp://www.fda.gov/cder/guidance/index.htmhttp://www.fda.gov/cber/guidelines.htm.%0Ahtt
31. Kiran DR. Total Quality Management: Key Concepts and Case Studies. India: BS Publication; 2017.
32. Zandieh M. Risk Assessment of Clean Room Used in Pharmaceutical Industries in Design , Manufacturing , Equipping and Operating Phases by FMEA Based on Some Chemical Engineering Concepts. Arch Pharma Pr. 2020;11:39–45.
cara mengutip artikel ini
https://jurnal.unpad.ac.id/farmasetika/rt/captureCite/46906/20181
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3