Majalah Farmasetika, 10 (6) 2025, 432-445
https://doi.org/10.24198/mfarmasetika.v10i6.65646
Artikel Penelitian
Ariani Insyirah1*, Taofik Rusdiana2, Ikhsan Rambia2
1Program Studi Profesi Apoteker, Fakultas Farmasi, Universitas Padjadjaran, Sumedang, Jawa Barat, Indonesia, 45363
2Fakultas Farmasi, Universitas Padjadjaran, Sumedang, Jawa Barat, Indonesia, 45363
*E-mail : ariani20001@mail.unpad.ac.id
(Submit 24/07/2025, Revisi 26/07/2025, Diterima 30/07/2025, Terbit 04/12/2025)
Abstrak
Industri farmasi memiliki peran dan tanggung jawab memastikan obat yang diproduksi aman, berkhasiat, dan bermutu sampai dikonsumsi oleh konsumen. Di Indonesia, terdapat PerBPOM Nomor 7 Tahun 2024 yang mengatur terkait seluruh proses dan ketentuan dalam pembuatan obat sehingga dapat memenuhi kriteria tersebut. Dalam proses pembuatan obat, salah satu hal yang perlu diperhatikan adalah terkait risiko kontaminasi dan ketercampuran saat penimbangan bahan baku. Potensi risiko tersebut dapat dikelola dengan cara melakukan kajian risiko. Salah satu metode pendekatan yang biasa digunakan adalah failure mode effect analysis (FMEA) yang berfokus pada tindakan pencegahan terjadinya kegagalan. Di industri farmasi “XYZ”, penilaian risiko biasa dilakukan dengan cara observasi secara langsung, melakukan wawancara dengan operator, dan berdiskusi dengan bagian tertentu terkait kemungkinan risiko yang dapat terjadi. Terdapat empat hal yang diidentifikasi, yaitu pakaian kerja, peralatan, kondisi ruangan, dan penandaan. Diperoleh total 11 risiko kegagalan dengan rincian lima berisiko rendah (terkait peralatan, kondisi ruangan, dan penandaan) dengan nilai RPN < 30, satu berisiko sedang (terkait penandaan) dengan nilai RPN 30 ≤ RPN ≤ 60, satu berisiko tinggi (terkait pakaian kerja) dengan nilai RPN 75 ≤ RPN ≤ 100, dan empat berisiko sangat tinggi (terkait pakaian kerja dan peralatan) dengan nilai RPN ≥ 150 sehingga menjadi prioritas utama yang perlu diselesaikan. Beberapa hal yang dapat dilakukan untuk mengurangi risiko adalah memberikan pelatihan operator, merevisi SOP secara berkala, memastikan formulir pemantauan diisi oleh operator, serta memastikan peralatan dan pakaian kerja yang digunakan memiliki jumlah dan spesifikasi yang sesuai dengan ketentuan. Hal tersebut sudah mulai diterapkan dan memberikan hasil yang baik. Dengan mengendalikan potensi risiko kontaminasi dan ketercampuran, obat yang dihasilkan oleh industri farmasi diharapkan memenuhi tiga kriteria terkait keamanan, khasiat, dan kualitas.
Kata kunci : Failure Mode Effects Analysis (FMEA), Industri Farmasi, Kajian Risiko,
Ketercampuran, Kontaminasi, Penimbangan,
Teks Lengkap:
Pendahuluan
Kesehatan merupakan hal yang penting bagi kehidupan manusia. Dalam upaya penyelenggaraan kesehatan di masyarakat, obat memiliki peran yang sangat penting karena hampir diberikan pada seluruh intervensi medik yang diberikan oleh dokter. Obat dapat memengaruhi kesembuhan penyakit, mencegah keparahan, atau mencegah komplikasi yang mungkin akan terjadi. Oleh karena itu, obat harus dipastikan memenuhi tiga kriteria, yaitu aman, berkhasiat, dan berkualitas (1). Ketiga hal tersebut dapat terpenuhi selama proses pembuatan, penyimpanan, pendistribusian, sampai dengan penyerahan obat kepada konsumen dilakukan sesuai dengan regulasi dan peraturan yang berlaku. Setelah obat sampai di tangan konsumen, ketiga kriteria tersebut harus tetap dijaga hingga dikonsumsi sepenuhnya (2). Industri farmasi memiliki peran penting dalam menyediakan obat-obatan yang aman, efektif, dan bermutu di masyarakat. Di Indonesia terdapat Peraturan Badan Pengawas Obat dan Makanan Nomor 7 Tahun 2024 tentang Standar Cara Pembuatan Obat yang Baik. Peraturan tersebut mengatur terkait aspek-aspek yang perlu diperhatikan selama proses pembuatan obat sehingga dapat memenuhi ketiga kriteria tersebut (3). Dalam proses pembuatan obat, salah satu hal yang perlu diperhatikan adalah terkait penimbangan bahan baku, baik penimbangan zat aktif maupun zat tambahan yang merupakan tahapan awal dalam proses produksi obat (4).
Kontaminasi dan ketercampuran pada proses produksi obat merupakan risiko yang harus diperhatikan oleh industri farmasi. Kontaminasi pada proses produksi obat mengacu pada saat zat kimia, mikroba, atau benda asing lain yang secara tidak sengaja masuk ke dalam bahan baku, bahan kemas, atau produk yang dapat memengaruhi keamanan, khasiat, dan mutu sehingga berpengaruh terhadap kesehatan konsumen (5). Beberapa hal yang dapat menjadi poin risiko terkait kontaminasi di industri farmasi adalah terkait bahan baku, peralatan, personel, tempat, tata letak fasilitas, sistem HVAC, dan sistem pengelolaan air. Oleh karena itu, perlu ada standar yang diterapkan untuk memastikan bahwa obat yang diproduksi aman, berkhasiat, dan bermutu (6). Ketercampuran (mix-up) pada proses produksi obat didefinisikan sebagai tertukarnya bahan, label, wadah, atau dokumen selama proses produksi. Hal tersebut dapat terjadi akibat adanya kelalaian dari personel, standard of procedure (SOP) yang tidak diikuti, atau karena identifikasi yang kurang jelas. Beberapa contoh ketercampuran di ruang penimbangan meliputi kesalahan penggunaan zat aktif atau zat tambahan, kesalahan penandaan peralatan atau bahan baku, dan sistem pemindahan material yang kurang tepat (7).
Secara umum, risiko (risk) didefinisikan sebagai kombinsi dari probabilitas terjadinya kerusakan atau bahaya (hazard) dengan tingkat keparahan (severity) yang disebabkan oleh kerusakan tersebut. Risiko dapat dihindari, dikelola, dan dimitigasi dengan cara membuat sistem dan prosedur yang baik, memiliki kualitas sumber daya manusia yang kompeten, dan mempunyai instrumen pendukung yang terkendali (8). Kajian risiko mutu yang termasuk dalam sistem manajemen risiko mutu dapat digunakan untuk mengelola risiko terkait kontaminasi dan ketercampuran di ruang penimbangan selama proses penimbangan bahan baku. Manajemen risiko mutu (MRM) atau quality risk management (QRM) adalah proses sistematis untuk menilai, mengendalikan, mengomunikasikan, dan mengkaji risiko terhadap mutu obat (9). Terdapat dokumen ICH Q9 yang mendefinisikan konsep dan prinsip manajemen risiko, menjelaskan prosedur penilaian risiko, dan mengusulkan contoh implementasinya (10). Terdapat dua prinsip utama dalam manajemen risiko mutu berdasarkan CPOB 2024, yaitu:
Evaluasi risiko terhadap mutu harus berdasarkan pengetahuan ilmiah dan dikaitkan dengan perlindungan pasien sebagai tujuan akhir;
Tingkat usaha, formalitas, dan dokumentasi terkait pengkajian risiko mutu seharusnya setara dengan tingkat risiko yang ditimbulkan (11).
Dalam manajemen risiko mutu terdapat beberapa metode pendekatan yang dapat digunakan, seperti: basic risk management facilitation methods (flowcharts, check sheets), failure mode effects analysis (FMEA), failure mode, effects and criticality analysis (FMECA), fault tree analysis (FTA), hazard analysis and critical control point (HACCP), hazard function analysis, preliminary hazard analysis (PHA), dan risk classification and filtering (12). Selain itu, terdapat metode pendekatan support statistical tool menggunakan control charts, design of experiment, pareto chart, atau probabilistic risk assessment (13). Metode pendekatan tersebut dapat dipilih berdasarkan tujuan analisis risiko, tahapan siklus hidup atau proses, kompleksitas sistem atau proses, ketersediaan data, besarnya potensi dampak keparahan, regulasi, dan sumber daya yang tersedia. Metode failure mode effects analysis (FMEA) sering digunakan oleh industri farmasi dalam manajemen risiko mutu karena metode tersebut berfokus pada pencegahan kegagalan dan meningkatkan kewaspadaan terkait keamanan, efikasi, dan mutu produk. Salah satu hal terpenting dari metode FMEA adalah tindakan preventif atau pencegahan (14). Oleh karena itu, metode FMEA dapat digunakan untuk memitigasi risiko terkait kontaminasi dan ketercampuran di ruang penimbangan industri farmasi “XYZ”.
Metode
Penelitian dilakukan secara observasional di industri farmasi “XYZ” yang terletak di Jawa Barat. Penilaian risiko terkait kontaminasi dan ketercampuran dilakukan dengan cara mengamati kesesuaian prosedur tetap (protap) atau SOP di industri farmasi “XYZ” terkait pencegahan pencemaran dan ketercampuran selama proses produksi. Beberapa prosedur dan kondisi, seperti pakaian kerja operator penimbangan, kondisi ruangan penimbangan, dan proses penimbangan bahan baku diamati secara langsung oleh penulis. Selain itu, dilakukan sesi wawancara kepada bagian operator penimbangan terkait proses penimbangan yang dilakukan sehari-hari. Kemudian dilakukan identifikasi kemungkinan-kemungkinan risiko yang dapat terjadi selama proses penimbangan bahan baku. Proses manajemen risiko mutu terdiri dari beberapa tahap, dimulai dengan penilaian risiko, pengendalian risiko, komunikasi risiko, dan diakhiri dengan pengkajian risiko.
Penilaian Risiko
Penilaian risiko merupakan suatu proses yang sistematis dalam penyusunan informasi untuk mendukung keputusan risiko yang dibuat dalam proses manajemen risiko. Penilaian risiko terdiri dari tiga hal, yaitu identifikasi, analisis, dan evaluasi risiko (11).
Identifikasi Risiko
Identifikasi risiko adalah informasi yang digunakan untuk mengidentifikasi dan mendefinisikan risiko yang relevan dengan permasalahan. Informasi yang diperoleh dapat terdiri dari riwayat data, analisis secara teoritis, atau opini (11). Riwayat data dapat membuktikan risiko melalui kejadian yang nyata, seperti hasil data dari laboratorium QC yang menunjukkan bahwa terdapat cemaran pada bahan baku yang melebihi persyaratan. Analisis secara teoritis dapat memprediksi risiko meskipun belum terjadi melalui suatu model, pengetahuan dasar industri, atau ilmu dasar, seperti literatur mikrobiologi yang menyatakan bahwa mikroorganisme dari kulit manusia, seperti Staphylococcus aureus, mudah berpindah melalui udara atau sentuhan (15). Sedangkan, opini dari ahli dapat mengantisipasi terjadinya suatu risiko berdasarkan pengalaman. Ketiga sumber informasi tersebut dapat digunakan untuk mengidentifikasi dan mendefinisikan risiko selama berdampak pada keamanan, khasiat, dan mutu produk serta relevan dan dapat dijustifikasi.
Analisis Risiko
Analisis risiko adalah estimasi terhadap risiko terkait dengan bahaya yang diidentifikasi (11). Risiko dinilai berdasarkan tiga parameter, yaitu tingkat keparahan, probabilitas, dan deteksi keparahan (16). Ketiga parameter tersebut diberikan nilai dalam rentang 1-5 atau 1-10 yang dapat disesuaikan dengan kebutuhan dari masing-masing industri farmasi (17). Tingkat keparahan (severity) didefinisikan sebagai dampak yang dihasilkan jika risiko kegagalan terjadi (18). Tingkat keparahan dapat dinilai dengan cara memberikan skor seperti pada Tabel 1. Skor tingkat keparahan yang semakin tinggi memiliki arti bahwa risiko kegagalan semakin berdampak buruk pada mutu produk.
Tabel 1. Kategori Tingkat Keparahan (S)

Tingkat probabilitas (probability atau occurrence) didefinisikan sebagai seberapa mungkin risiko kegagalan terjadi. (18). Tingkat probabilitas dapat dinilai dengan cara memberikan skor seperti pada Tabel 2. Skor tingkat probabilitas yang semakin tinggi memiliki arti bahwa risiko kegagalan sangat mungkin terjadi.
Tabel 2. Tingkat Probabilitas (P)

Tingkat deteksi (detection) didefinisikan sebagai kemampuan risiko kegagalan dideteksi sebelum terjadi (18). Tingkat deteksi dapat dinilai dengan cara memberikan skor seperti pada Tabel 3. Skor tingkat deteksi yang semakin tinggi memiliki arti bahwa belum ada deteksi yang dilaksanakan oleh industri farmasi atau deteksi yang tersedia tidak berjalan sesuai dengan yang seharusnya.
Tabel 3. Tingkat Deteksi (D)

Evaluasi Risiko
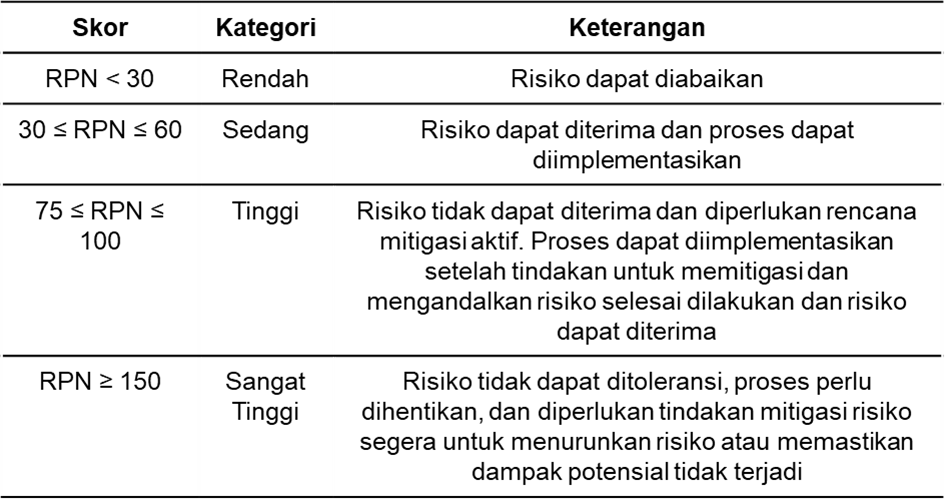
Evaluasi risiko merupakan kegiatan membandingkan risiko yang sudah diidentifikasi dan dianalisis terhadap kriteria risiko yang telah ditentukan (11). Evaluasi risiko dilakukan dengan cara menentukan nilai risk priority number (RPN) untuk memprioritaskan risiko kegagalan yang tindakan korektifnya akan ditentukan. Nilai RPN diperoleh dengan cara menghitung berdasarkan rumus berikut, yaitu nilai RPN = nilai keparahan (s) x nilai kejadian (p) x nilai deteksi (d) (19). Setelah diperoleh hasil nilai RPN, risiko digolongkan berdasarkan empat kategori, yaitu kategori rendah, sedang, tinggi, dan sangat tinggi seperti pada Tabel 4. Nilai RPN yang sangat tinggi memiliki arti bahwa risiko tersebut akan menjadi prioritas utama untuk dikendalikan atau diselesaikan (20). Akan tetapi, terkadang nilai RPN menunjukkan hasil nilai yang sama dari kombinasi nilai tiga parameter yang berbeda sehingga perlu dilakukan analisis lebih lanjut untuk menilai pasti dari suatu faktor risiko (21).
Tabel 4. Kategori Risiko berdasarkan RPN
Pengendalian Risiko
Pengendalian risiko merupakan tindakan pengambilan keputusan untuk mengurangi dan/atau menerima risiko (11). Tahap ini bertujuan untuk mengurangi risiko sampai dengan batas yang dapat diterima. Terdapat dua kegiatan pada tahap ini, yaitu:
Pengurangan Risiko
Pengurangan risiko merupakan tindakan yang dilakukan sesuai persyaratan mutu untuk mengurangi probabilitas terjadinya kegagalan dan mengurangi tingkat keparahan dari kegagalan tersebut (22).
Penerimaan Risiko
Penerimaan risiko adalah suatu keputusan untuk menerima risiko. Pada tahap ini, dapat terlihat bahwa manajemen risiko mutu yang digunakan telah dilaksanakan sehingga risiko berkurang dan dapat diterima (12). Ambang batas pengurangan dan penerimaan risiko didasari oleh tingkatan risiko yang masih dapat diterima dan telah ditentukan oleh masing-masing industri farmasi.
Komunikasi Risiko
Komunikasi risiko merupakan proses berbagi informasi mengenai risiko dan manajemen risiko antara pembuat kebijakan dengan pemangku kepentingan lainnya. Komunikasi risiko berada pada setiap proses manajemen risiko mutu. Hasil akhir dari proses manajemen risiko mutu harus dikomunikasikan dengan benar dan didokumentasikan dengan baik (11).
Pengkajian Risiko
Pengkajian risiko merupakan kajian atau pemantauan terhadap keluaran atau hasil proses manajemen risiko dengan mempertimbangkan pengetahuan dan pengalaman terkait risiko (11). Frekuensi pengkajian risiko dilakukan dengan mempertimbangkan tingkat risiko kegagalan, apakah sangat tinggi, tinggi, sedang, atau rendah. Tingkat risiko kegagalan tersebut didasari oleh hasil nilai RPN yang diperoleh pada saat melakukan kajian risiko menggunakan metode FMEA.
Hasil
Hasil penelitian terkait risiko kegagalan yang dilakukan di ruang penimbangan industri farmasi “XYZ” dengan melakukan observasi dan diskusi terkait potensi kegagalan yang mungkin terjadi terhadap proses penimbangan bahan baku tercantum pada Tabel 5. Terdapat empat kategori yang diidentifikasi, yaitu terkait pakaian kerja operator, peralatan, kondisi ruangan, dan penandaan.
Tabel 5. Hasil Kajian Risiko Metode FMEA
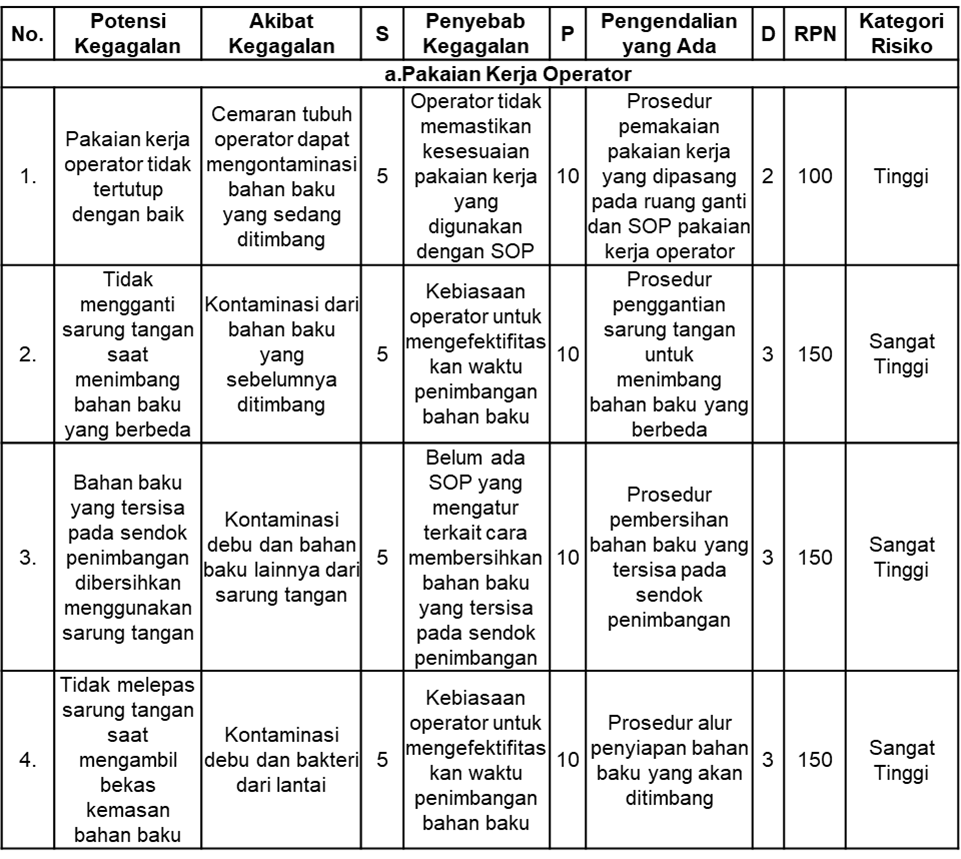
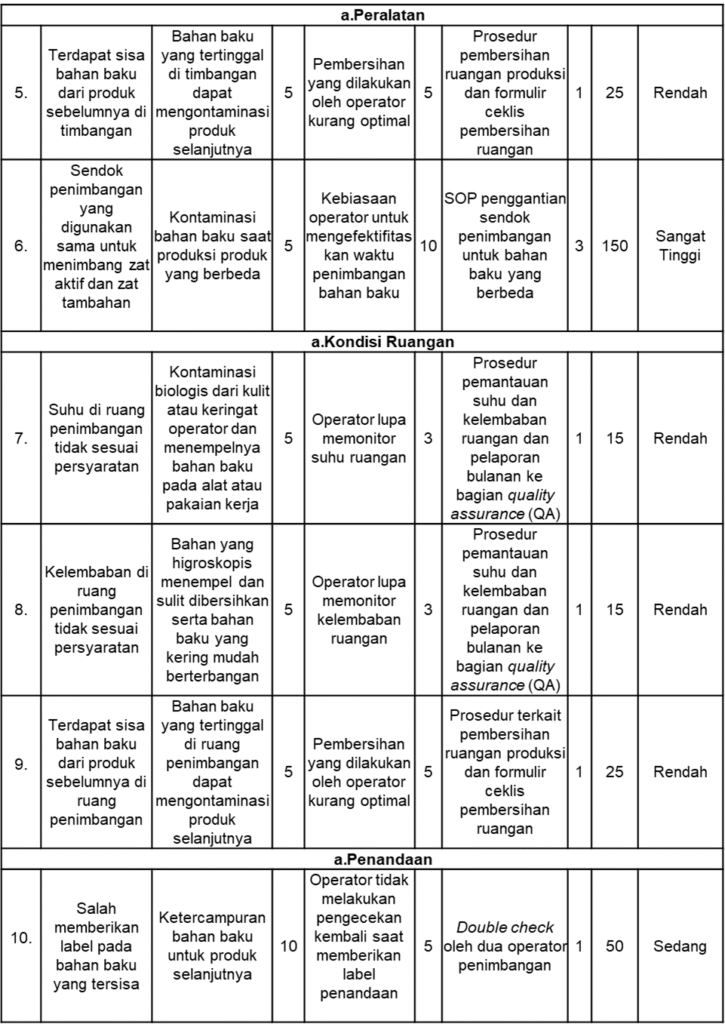
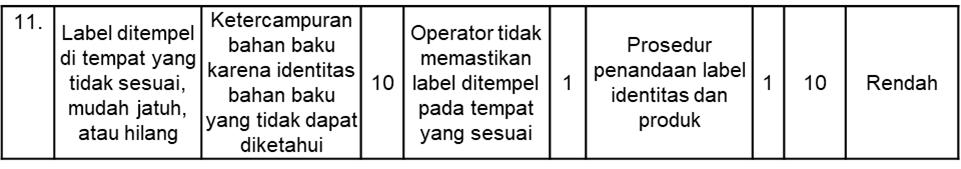
Berdasarkan hasil identifikasi, analisis, dan evaluasi risiko yang telah dilakukan, diperoleh rekapitulasi risiko yang mungkin terjadi saat proses penimbangan bahan baku di ruang penimbangan industri farmasi “XYZ” yang disusun seperti pada Tabel 6.
Tabel 6. Rekapitulasi Risiko yang Mungkin Terjadi

Pembahasan
Industri farmasi memiliki peran dan tanggung jawab untuk memastikan bahwa obat yang diproduksi aman, berkhasiat, dan bermutu sampai dengan dikonsumsi oleh konsumen. Keamanan (safety) memiliki arti bahwa obat tidak akan menimbulkan efek yang berbahaya bagi konsumen selama digunakan sesuai dengan dosis atau aturan pakai. Khasiat (efficacy) memiliki arti bahwa obat bisa memberikan hasil yang sesuai dengan harapan. Sedangkan kualitas atau mutu (quality) memiliki arti bahwa produksi obat memiliki konsistensi, stabilitas, dan kepatuhan terhadap spesifikasi yang ditetapkan. Obat yang tidak memenuhi ketiga kriteria tersebut dapat berisiko terhadap kesehatan konsumen, seperti memperburuk kesehatan, membuat kegagalan fungsi organ, bahkan menyebabkan kematian (23).
Penimbangan bahan baku merupakan salah satu hal yang perlu diperhatikan dalam proses pembuatan obat karena akan memengaruhi mutu obat yang diproduksi. Salah satu masalah yang dapat terjadi pada saat proses penimbangan adalah adanya risiko terkait kontaminasi dan ketercampuran pada bahan baku, baik zat aktif maupun zat tambahan yang digunakan untuk produksi obat (24). Untuk mengidentifikasi risiko yang dapat berpengaruh secara signifikan terhadap suatu proses atau kegiatan, industri farmasi dapat menerapkan manajemen risiko mutu (25).
Risiko yang diidentifikasi terkait kontaminasi dan ketercampuran selama proses penimbangan di ruang penimbangan industri farmasi “XYZ” adalah terkait pakaian kerja operator, peralatan, kondisi ruangan, dan penandaan. Berdasarkan hasil kajian risiko menggunakan metode failure mode effects analysis (FMEA), diperoleh total 11 risiko kegagalan pada proses penimbangan bahan baku dengan rincian 5 risiko berada dalam kategori rendah, 1 risiko berkategori sedang, 1 risiko berkategori tinggi, dan 4 risiko berkategori sangat tinggi. Penilaian tersebut diperoleh berdasarkan hasil nilai RPN yang membantu menentukan prioritas utama risiko yang harus diperbaiki (26).
Risiko Sangat Tinggi
Empat risiko terkait pakaian kerja operator dan peralatan yang termasuk dalam kategori sangat tinggi akan menjadi prioritas untuk menentukan tindakan preventif dan pengendalian terhadap risiko kegagalan yang sebelumnya sudah teridentifikasi. Risiko kegagalan terkait dengan pakaian kerja operator adalah tidak mengganti sarung tangan saat menimbang bahan baku yang berbeda, membersihkan bahan baku yang tersisa pada sendok penimbangan langsung menggunakan sarung tangan, dan tidak melepas sarung tangan pada saat mengambil bekas kemasan bahan baku. Hal tersebut dapat menyebabkan adanya kontaminasi debu atau bakteri dari lantai serta kontaminasi dari bahan baku yang sebelumnya ditimbang. Kontaminasi dari bakteri menjadi permasalahan yang serius dalam industri farmasi karena dapat memengaruhi kesehatan konsumen. Hal tersebut juga dapat menyebabkan penarikan produk (recall), hilangnya reputasi industri farmasi, hingga kerugian secara finansial (27). Sedangkan risiko kegagalan terkait dengan peralatan adalah operator menggunakan sendok penimbangan yang sama untuk menimbang zat aktif dan zat tambahan. Hal tersebut dapat menyebabkan adanya kontaminasi bahan baku dari produk yang berbeda. Peralatan yang digunakan selama proses produksi, terutama pada saat penimbangan bahan baku yang berbeda perlu dibersihkan secara menyeluruh untuk memastikan bahwa tidak ada bahan baku dari produk lain yang tersisa. Selain itu, perlu dipastikan bahwa peralatan yang digunakan memiliki kuantitas yang sesuai dengan kebutuhan operator. Kedua hal tersebut bertujuan untuk menghasilkan produk sesuai dengan persyaratan mutu yang berlaku (28).
Risiko Tinggi
Risiko yang termasuk dalam kategori tinggi adalah terkait pakaian kerja operator yang tidak tertutup dengan baik. Risiko tersebut harus dimitigasi karena Staphylococcus merupakan salah satu mikroorganisme yang umumnya terdapat di area kulit dan memiliki sumber penyebaran terutama di bagian kulit, rambut, atau saluran pernapasan (29). Kontaminasi mikroorganisme dari tubuh operator dapat memengaruhi mutu obat yang diproduksi.
Risiko Sedang
Risiko yang termasuk dalam kategori sedang adalah terkait penandaan, yaitu kesalahan pemberian label pada bahan baku yang masih tersisa. Risiko berkategori sedang dapat diterima karena tingkat deteksi yang dirancang sudah diimplementasikan dan memiliki hasil sesuai dengan yang diharapkan (16). Selama proses penimbangan berlangsung, terdapat dua orang operator yang selalu melakukan double check terkait penandaan dan dokumentasi sehingga risiko tersebut akan mudah terdeteksi.
Risiko Rendah
Risiko yang termasuk dalam kategori rendah adalah terkait peralatan, kondisi ruangan, dan penandaan. Risiko berkategori rendah dapat diabaikan karena tidak menimbulkan dampak yang signifikan terhadap mutu produk, kemungkinan terjadinya rendah, atau karena terdapat tingkat deteksi yang sudah diimplementasikan (16).
Beberapa risiko kegagalan disebabkan oleh kurangnya kesadaran dan pemahaman operator penimbangan terhadap SOP yang telah ditetapkan oleh industri farmasi. Operator merupakan seseorang yang memiliki tugas dalam menjaga dan menjalankan suatu peralatan atau mesin sesuai dengan bagian penempatannya (30). Beberapa kebiasaan operator untuk mengefektifitaskan proses penimbangan bahan baku dapat menjadi sumber potensi terjadinya kontaminasi dan ketercampuran. Untuk mengurangi risiko tersebut, industri farmasi dapat melakukan beberapa tindakan, seperti memberikan pelatihan operator secara berkala. Pelatihan tersebut bertujuan memastikan bahwa operator telah memahami SOP yang berlaku di industri farmasi dan memahami tanggung jawab individu yang dimiliki (31). Selain itu, beberapa hal lain yang dapat dilakukan untuk mencegah risiko terjadinya kontaminasi dan ketercampuran selama proses penimbangan bahan baku adalah dengan melakukan pembaruan SOP secara berkala, memastikan formulir pemantauan suhu dan kelembaban serta formulir pembersihan ruangan diisi dan dilaporkan oleh operator secara rutin. Proses produksi menjadi komponen yang sangat penting dalam menjaga kesehatan masyarakat karena obat yang diproduksi oleh industri farmasi harus aman, berkhasiat, dan berkualitas (32). Selain itu, industri farmasi juga harus memastikan bahwa peralatan dan pakaian kerja operator yang akan digunakan selama proses penimbangan bahan baku memiliki jumlah dan spesifikasi yang sesuai dengan ketentuan. Oleh karena itu, pengendalian terkait risiko kontaminasi dan ketercampuran selama proses produksi terutama pada tahapan penimbangan bahan baku perlu diidentifikasi dan dikaji sehingga diperoleh solusi yang dapat menjawab permasalahan tersebut. Hasil kajian risiko telah didokumentasikan, disampaikan dan didiskusikan kepada para pemangku kebijakan yang terlibat, seperti wakil kepala bagian produksi dan quality assurance serta diketahui secara langsung oleh plant manager industri farmasi “XYZ”.
Kesimpulan
Berdasarkan hasil kajian risiko menggunakan metode FMEA terkait kontaminasi dan ketercampuran di ruang penimbangan industri farmasi “XYZ”, dapat disimpulkan bahwa berdasarkan hasil observasi secara langsung, wawancara dengan operator penimbangan, dan berdiskusi terkait identifikasi kemungkinan-kemungkinan risiko yang dapat terjadi selama proses penimbangan bahan baku terdapat total 11 risiko kegagalan dengan rincian 5 berisiko rendah, 1 berisiko sedang, 1 berisiko tinggi, dan 4 berisiko sangat tinggi. Risiko kegagalan terutama yang berada dalam kategori sangat tinggi dan tinggi, yaitu terkait pakaian kerja operator serta perlatan perlu dikendalikan. Beberapa tindakan yang dapat dilakukan oleh industri farmasi adalah dengan melaksanakan pelatihan operator dan memperbarui SOP secara berkala, memastikan formulir pemantauan diisi oleh operator, serta memastikan peralatan dan pakaian kerja yang digunakan selama proses penimbangan bahan baku memiliki jumlah dan spesifikasi yang sesuai dengan ketentuan. Dengan mengendalikan potensi risiko kontaminasi dan ketercampuran selama proses penimbangan bahan baku, harapannya produk obat yang dihasilkan memiliki keamanan, khasiat, dan kualitas yang terjamin.
Daftar Pustaka
1.Sigalingging, O. S. dan Musfiroh, I. Analisis Kualifikasi Pemasok Obat di Salah satu Pedagang Besar Farmasi (PBF) di Kota Bandung. Majalah Farmasetika. 2022;7(5):469-477.
2.Fazila, E., Megantara, S., dan Gracia, A. Analisis Risiko Kualifikasi Pemasok dan Pendekatan Mitigasi Risikonya dalam Manajemen Rantai Pasok Industri Farmasi. Jurnal Mahasiswa Ilmu Farmasi dan Kesehatan. 2025;3(2):69-87.
3.Priscila, C., Flavia, M., dan Kelen, S. Risk Analysis Evaluation of Piroxicam 20mg Capsules Manufacture Process by FMEA Technique. International Journal of Drug Regulatory Affairs. 2018;6(1):19-25.
4.Defriandi, M. dan Ramdhan, D. H. Evaluasi Pengendalian Teknik Pajanan Active Pharmaceutical Ingredient (API) di Proses Penimbangan Obat PT. XY. PREPOTIF Jurnal Kesehatan Masyarakat. 2022;6(2):1184-1191.
5.Eulambius, M. Pharmaceutical Product Cross-Contamination: Industrial and Clinical Pharmacy Practice. Dar Es Salaam Medical Students’ Journal. 2013;19(2):17-19.
6.Lutovska, K. dan Dodov, M. G. Cross-Contamination in Pharmaceutical Industry: Types, Measures, and Good Practices. Macedonian Pharmaceutical Bulletin. 2022;68(Suppl 1):597-598.
7.Pathodiya, M. Cross-Contamination Risk Assessment using FMEA Tool. Journal of Drug Delivery and Therapeutics. 2024;14(9):164-167.
8.Simanjuntak, E. U. E. dan Megantara, S. Kajian Risiko Proses Penyediaan Produk Semisolid Industri X di Cikarang Selatan. Majalah Farmasetika. 2023;8(1):44-55.
9.Azzahra, A. M. dan Sriwidodo. Penilaian Risiko menggunakan Metode Failure Mode and Effects Analysis (FMEA) terkait Kontaminasi Silang pada Area Pengemasan di Industri Farmasi “XYZ”. Obat: Jurnal Riset Ilmu Farmasi dan Kesehatan. 2024;2(5):1-11.
10.European Medicines Agency. ICH Guideline Q9 on Quality Risk Management. United Kingdom: European Medicines Agency; 2015.
11.Badan Pengawas Obat dan Makanan Republik Indonesia. Peraturan Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 7 Tahun 2024 tentang Standar Cara Pembuatan Obat yang Baik. Jakarta: BPOM RI; 2024.
12. Aswini, V. dan Kathiresan, K. Quality Risk Management (QRM): A Review. International Journal of Biology, Pharmacy, and Allied Sciences. 2022;11(10):4667-4678.
13. Khristi, A. dan Khristi, P. A Review on “Failure Mode and Effects Analysis-A Tool of Quality Risk Management” Based on ICH Q9. International Journal of Research in Pharmacy and Chemistry. 2018;8(1):33-43.
14. Mascia, A., Cirafici, A. M., Bongiovanni, A., Colotti, G., Lacerra, G., Di Carlo, M., Digillo, F. A., Liguori, G. L., Lanati, A., dan Kisslinger, A. A Failure Mode and Effect Analysis (FMEA)-Based Approach for Risk Assessment of Scientific Processes in Non-Regulated Research Laboratories. Accreditation and Quality Assurance. 2020;25(5–6):311-321.
15. Kozajda, A., Jezak, K., dan Kapsa, A. Airbone Staphylococcus aureus in Different Environments-A Review. Environmental Science and Pollution Research. 2019;26(34):34741-34753.
16. Musyaffa, H. A., Roestan, M. R., Nurrasjid, E. S., dan Kustiyawan, I. Kajian Risiko pada Proses Penyimpanan dan Pendistribusian Bahan Baku di Gudang Industri Farmasi dengan Pendekatan Metode Failure Mode and Effect Analysis. Jurnal Ilmu Kesehatan dan Gizi. 2024;2(3):202-211.
17. Shufianti, H. dan Sudiarno, A. Risk Analysis on Documentation Unit Workload in Pharmaceutical Company using Failure Mode and Effect Analysis (FMEA). Jurnal Teknobisnis. 2022;8(2):109-123.
18. Timang, G. A., Maulluddy, R., dan Darmawan, M. Quality Improvement of Non-Betalactam Drug Products using the Six Sigma Method at PT XYZ. Jurnal Media Teknik & Sistem Industri. 2024;8(1):38-50.
19. Wu, X. dan Wu, J. The Risk Priority Number Evaluation of FMEA Analysis Based on Random Uncertainty and Fuzzy Uncertainty. Complexity. 2021;(1):8817667.
20. Zandieh, M. Risk Assessment of Clean Room Used in Pharmaceutical Industries in Design, Manufacturing, Equipping and Operating Phases by FMEA Based on Some Chemical Engineering Concepts. Archives of Pharmacy Practice. 2020;11: 39-45.
21. Susendi, N., Adrian, dan Sopyan, I. Kajian Metode Root Cause Analysis yang Digunakan dalam Manajemen Risiko di Industri Farmasi. Majalah Farmasetika. 2021;6(4):310-321.
22. Ismael, O. A. dan Ahmed, M. I. Using Quality Risk Management in Pharmaceutical Industries: A Case Study. QUALITY Access to Success. 2020;21(178):106-113.
23. Yulianingsih, T. A., Turisno, B. E., dan Aminah. Pemberdayaan Konsumen dalam Mencegah Peredaran Obat Palsu di Masyarakat. Diponegoro Law Journal. 2016;5(4):1-11
24. Sargent E. V., Flueckiger, A., Barle, E. L., Luo, W., Molnar, L. R., Sandhu, R., dan Weideman, P. A. The Regulatory Framework for Preventing Cross-Contamination of Pharmaceutical Products: History and Considerations for the Future. Regulatory Toxicology and Pharmacology. 2016;79(S1): S3-S10.
25. Mandhare, T.A., Khuspe, P.R., Nangare, P.S., dan Vyavhare, R.D. Quality Risk Management: A Review. American Journal of Pharmtech Research. 2018;8(2): 56-86.
26. Damayanti, C. dan Hasanah, A. N. Penilaian Risiko Kontaminasi Silang pada Area Produksi pada Salah Satu Industri Farmasi di DKI Jakarta. Majalah Farmasetika. 2023;8(5):424-446.
27. Hashim, Z. A. dan Celiksoy, V. Pharmaceutical Products Microbial Contamination: Approaches of Detection and Avoidance. Microbes and Infectious Diseases. 2025;6(1):159-170.
28. Anshika, S., Garima, V., dan Rani, D. D. Current Good Manufacturing Guidelines for Medical Product. Journal of Delivery and Therapeutics. 2016;6(2):57-61.
29. Yennie, Y., Dewanti-Hariyadi, R., Kusumaningrum, H. D., dan Poernomo, A. KONTAMINASI Staphylococcus aureus DAN Bacillus cereus PADA SUSYI DI TINGKAT RITEL DI WILAYAH JABODETABEK. Jurnal Pengolahan Hasil Perikanan Indonesia. 2022;25(2):331-344.
30. Hutapea, E. E. dan Musfiroh, I. Artikel Tinjauan: Sistem Kualifikasi Operator di Industri Farmasi. Suplemen Farmaka. 2021;53-59.
31. Venkatesh, C. dan Puranik, B. S.Importance of Self-Inspection in Pharmaceutical Industry as Per Various Regulatory Guidelines. Biomed Pharmacol J. 2018;11(1).
32. Anugrah, R., Kairupan, D. N., Putri, F. L., Ulfa, M., dan Pratama, F. Study of Contamination Control in the Pharmaceutical Industry: Ethylene Glycol and Diethylene Glycol. Jurnal Kesehatan Lingkungan. 2023;20(2):191-200.
cara mengutip artikel
https://jurnal.unpad.ac.id/farmasetika/rt/captureCite/65646/0
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3