Majalah Farmasetika, 5 (5) 2020, 245-256 https://doi.org/10.24198/mfarmasetika.v5i5.28866
Download PDF
Nining Nining
Fakultas Farmasi dan Sains, Universitas Muhammadiyah Prof. DR. HAMKA Jl. Delima II, Jakarta, Indonesia, 13460
*E-mail: nining@uhamka.ac.id
(Submit 29/7/2020, Revisi 6/8/2020, Diterima 13/8/2020)
Abstrak
Kolagen laut atau marine collagen merupakan biomaterial yang memiliki potensi besar dalam pemanfaatannya di bidang farmasi karena keberlimpahannya di alam. Penelitian mengenai sistem penghantaran obat dengan carrier kolagen laut telah banyak diteliti dan dilaporkan. Artikel ini merupakan review mengenai studi yang dilakukan dalam pemanfaatan kolagen laut dalam berbagai sistem penghantaran obat. Metode yang digunakan adalah melalui pencarian data jurnal nasional maupun internasional dengan menggunakan mesin pencari berupa Google, Google Scholar, Science Direct, Pubmed dan lainnya. Berdasarkan sumbernya, kolagen laut dikasifikasikan menjadi dua yaitu kolagen yang berasal dari invertebrata dan vertebrata. Biomaterial ini memiliki karakteristik yang unik dari segi kimia, fisika, dan biologi. Sistem penghantaran yang telah dikembangkan dan dilaporkan berupa sistem partikulat, film, gel dan hidrogel, enteric-coating tablet, serta sponge. Pengembangan sistem penghantaran obat lainnya dengan kolagen yang bersumber dari keanekaragaman hayati perikanan dan kelautan Indonesia menjadi peluang dan tantangan di masa yang akan datang.
Kata Kunci
kolagen laut; biomaterial; sistem penghantaran obat
Pendahuluan
Kolagen yang banyak beredar dipasarkan saat ini umumnya berasal dari sapi dan babi. Tetapi penggunaan kedua jenis kolagen tersebut memiliki kendala pada kesehatan dan agama. Kolagen yang berasal dari sapi beresiko terkontaminasi bovine spongiform encephalophaty (BSE), transmissible spongiform encephalophathy (TSE) dan foot and
Pendahuluan
Warfarin adalah obat antikoagulan dengan mekanisme kerja menghambat produksi vitamin K di hati. Warfarin diklasifikasikan sebagai obat high-alert1, memiliki indeks terapi yang sempit, dan membutuhkan dosis yang tepat karena memberikan respons yang berbeda pada setiap individu pasien. Insiden perdarahan besar diperkirakan terjadi 3% akibat antikoagulan oral warfarin2. Oleh karena itu, pemantauan terapi perlu dilakukan untuk meminimalkan efek samping yaitu mengukur derajat antikoagulasi setiap individu pasien dengan uji waktu protrombin (prothrombin time, PT) yang dinyatakan sebagai Rasio Normalisasi Internasional (International Normalization Ratio, INR) dengan nilai INR rekomendasi yaitu 2,0-3,03,4. Meskipun antikoagulan baru lebih menguntungkan karena tidak memerlukan pemantauan rutin seperti warfarin5, namun warfarin tetap banyak digunakan di dunia karena masih memerlukan studi lebih lanjut mengenai alasan penggantian warfarin menjadi antikoagulan oral baru. Selain itu, keterjangkauan warfarin menjadikannya pilihan tepat yang disukai oleh klinik yang melayani populasi pasien berpenghasilan rendah6.
Pengetahuan pasien dalam terapi warfarin sangat penting karena kontrol antikoagulasi dapat ditingkatkan, ditandai dengan penurunan reaksi obat merugikan dan komplikasi yang berkaitan7. Pasien memiliki peningkatan risiko komplikasi perdarahan seperti darah dalam urin dan memar yang tidak biasa8, serta melakukan rawat inap di rumah sakit sebesar 50% jika pengetahuan kesehatan yang dimiliki pasien sangat terbatas dibandingkan dengan pasien yang memiliki pengetahuan kesehatan yang memadai. Pengetahuan terkait warfarin meliputi mekanisme aksi, efek samping, interaksi, dan frekuensi pemantauan. Pengetahuan kesehatan yang terbatas ini kemudian akan Tingginya biaya rawat inap terkait dengan efek samping dari warfarin menunjukkan pentingnya pendekatan baru untuk pendidikan kesehatan standar pada warfarin9.
Pemberian pendidikan kepada pasien terkait kesehatan dapat meningkatkan pengetahuan pasien dengan efektif dimana hasilnya pun diharapkan memberikan kesehatan jangka panjang karena kepatuhan pasien selama pengobatan juga meningkat. Kemajuan teknologi pada era globalisasi ini merupakan salah satu strategi dalam mendukung pendidikan kesehatan10. Penyampaian pendidikan tentang terapi dalam hal ini warfarin, melalui media elektronik secara daring dapat memberikan peluang pendidikan unik dan terintegrasi pada teknologi modern dalam pengaturan perawatan kesehatan yang ditargetkan untuk mengetahui dan meningkatkan pengetahuan, sikap, perilaku dan kepatuhan pasien tentang penyakit dan perawatannya. Namun, belum banyak penelitian yang menyelidiki penggunaan media elektronik sebagai fasilitas pendidikan warfarin11,12.
Aspek lain seperti masalah biaya, waktu dan tenaga yang diperlukan oleh tenaga kesehatan khususnya apoteker dalam memberikan pendidikan kepada pasien, serta meningkatkan daya tarik pasien untuk kepatuhan yang lebih baik menjadi pertimbangan pendidikan warfarin secara daring dilakukan. Penulisan kajian pustaka ini dibuat dengan tujuan untuk mengulas dan memberikan gambaran mengenai peran dari sebuah inovasi pendidikan warfarin secara daring terhadap kepatuhan pasien dalam pengobatan warfarin agar tercapainya nilai INR yang direkomendasikan, sehingga strategi pendidikan warfarin secara online dapat dikembangkan terutama di Indonesia8.
mouth disease (FMD) yang terjadi selama beberapa dekade terakhir1. Banyak peneliti mencari alternatif lain dalam memenuhi kebutuhan kolagen yang bersifat imunogenisitas rendah, biokompatibel, dan berpotensi rendah dalam penyebab transmisi penyakit. Bahan baku yang berpotensi digunakan sebagai sumber kolagen adalah yang berasal dari sektor perikanan dan kelautan.
Lebih dari 70% bumi tercakup oleh lautan yang dihuni oleh keanekaragaman organisme hidup. Lingkungan laut menyediakan berbagai sumber kolagen dan material bioaktif yang digunakan di berbagai bidang termasuk industri farmasi, kosmetik, dan makanan2. Kolagen terbukti cocok dalam pemanfaatan kosmetik dan industri biomedis. Sumber-sumber laut telah menarik minat sebagian besar peneliti, karena dapat dengan mudah diperoleh dalam hasil tinggi dan biaya rendah3. Kolagen tipe I adalah protein yang paling banyak diekstraksi dari hewan laut, karena merupakan biomaterial yang sangat penting di bidang rekayasa jaringan. Kolagen tipe II dapat diperoleh dari tulang rawan ikan. Beberapa ubur-ubur seperti ubur-ubur Pita (Chrysaora sp) memiliki kandungan kolagen tipe II yang tinggi4 dan sponge laut, seperti Chondrosia reniformis diketahui mengandung kolagen tipe IV5. Sumber-sumber ini dapat berfungsi sebagai sumber kolagen laut untuk obat-obatan dan keperluan industri6. Kolagen laut baru-baru ini dilaporkan sebagai biomaterial baru untuk kultur sel dan jaringan sebagai alternatif dari kolagen mamalia konvensional, seperti kolagen sapi dan babi7.
Metode
Dilakukan penelusuran jurnal ilmiah terpublikasi taraf nasional dan internasional melalui mesin pencari berupa Google, Google Scholar, Science Direct, dan Pubmed dengan menggunakan kata kunci berupa “kolagen laut”, “nanopartikel”, “marine collagen”, “extraction marine collagen”, dan “drug delivery system”. Pencarian kata kunci tersebut dilakukan dengan menggunakan Bahasa Indonesia dan Bahasa Inggris. Penelusuran lebih lanjut dilakukan secara manual daftar pustaka yang relevan dengan kriteria inklusi yaitu waktu terbit dengan rentang tahun 2000 – 2020.
Kolagen Laut
Kolagen adalah protein yang mayoritas dibentuk oleh asam amino glisin (33%), prolin dan hidroksiprolin (22%) (struktur primer) dalam tripleks-heliks yang dibentuk oleh tiga rantai α. Setiap rantai α tersusun atas 1014 asam amino dengan berat molekul berkisar sekitar 100 kDa. Pada Gambar 1c, rantai ini bergelung menjadi heliks ke arah kiri dengan tiga asam amino per belokan (struktur sekunder). Rantai berpilin satu sama lain menjadi tripel-heliks untuk membentuk struktur yang kaku (struktur tersier). Super-heliks mewakili struktur kolagen dasar (struktur kuaterner). Struktur kolagen ini sangat stabil karena ikatan hidrogen intramolekul antara glisin dalam rantai yang berdekatan (Gambar 1b). Molekul kolagen dibentuk untuk daerah tripel-heliks dan dua daerah nonheliks di kedua ujung (Gambar 1a) struktur heliks dengan berat molekul berkisar 300 kDa, panjang 280 nm, dan diameter 1,4 nm8.
Berdasarkan sumbernya, kolagen laut dikategorikan menjadi dua yaitu kolagen yang diisolasi dari hewan invertebrata seperti sotong, anemon laut, udang, ikan bintang,

Gambar 1. a) Struktur kolagen tripel-heliks b) Ikatan hidrogen antar kolagen tripel-heliks c) cross-section kolagen tripel-heliks.8
ubur-ubur2,3,4,5, spons12, bulu babi, gurita, dan cumi-cumi13. Kategori lainnya adalah kolagen laut yang bersumber dari vertebrata laut yang mencakup ikan dan mamalia laut. Pada ikan, kolagen biasanya diekstraksi dari daging, kulit, sirip, sisik dan limbah ikan, setelah kolagen ikan diekstraksi dapat dimurnikan untuk digunakan dalam kosmetik, medis, olahraga, nutrisi dan lainnya. Dapat diproses lebih lanjut untuk membentuk biomaterial fungsional termasuk rangka (scaffold), sponge, gel, komposit, dan membran untuk rekayasa jaringan. Mamalia laut dapat diekstraksi dari paus, anjing laut, berang-berang laut, beruang kutub, dan lainnya. Namun, hingga saat ini, hanya sedikit mamalia laut yang diketahui dieksplorasi untuk sumber kolagen, misalnya paus Minke (Balaenoptera acutorostra) dilaporkan memiliki kolagen tipe I14.
Proses Ekstraksi
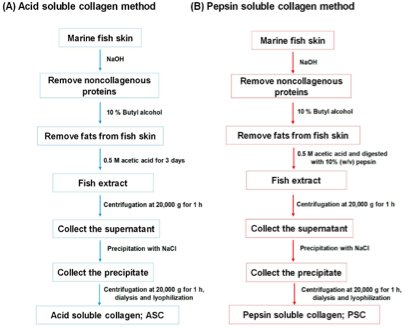
Proses ekstraksi yang berbeda kemungkinan akan menghasilkan kolagen dengan karakteristik yang berbeda sesuai dengan kelarutannya15. Perbedaan spesies dan habitat juga sangat mempengaruhi proses pre-treatment dan ekstraksi untuk mendapatkan kolagen dengan kemurnian sesuai standar. Kelarutan kolagen dalam air dingin diketahui buruk karena adanya ikatan silang yang kuat dalam struktur tripel-heliksnya. Kelarutannya dapat ditingkatkan dengan pemanasan dan perlakuan kimiawi pada jaringan hewan sebelum ekstraksi untuk memutus hubungan silang dengan penambahan asam atau basa encer. Pre-treatment kondisi asam memotong ikatan non-kovalen inter dan intra-molekul sementara pre-treatment kondisi basa menghilangkan protein non-kolagen tanpa menyebabkan modifikasi struktural pada rantai kolagen16. Asam asetat adalah asam encer yang paling banyak digunakan untuk ekstraksi kolagen dari jaringan hewan laut, selain itu dapat juga digunakan asam sitrat dan asam laktat. Penambahan enzim juga dimungkinkan untuk mendapatkan produk protein spesifik, hasil produk tinggi dan mengurangi limbah17. Produk kolagen yang merupakan hasil ekstraksi asam disebut acid soluble collagen (ASC) dan ketika ada penambahan enzim, umumnya pepsin, kolagen hasil ekstraksi disebut pepsin soluble collagen (PSC).

Gambar 2. Diagram alir untuk isolasi kolagen dari kulit ikan laut. (A) metode acid soluble collagen (ASC) dan (B) pepsin soluble collagen (PSC)2
Invertebrata laut seperti ubur-ubur mengandung banyak air dalam tubuhnya (95%), yang mempengaruhi kelarutan kolagen dalam asam asetat. Penggunaan homogenizer atau freeze-dryer pada bahan baku sebelum ekstraksi meningkatkan kelarutan kolagen dalam asam encer. Sebagai contoh, hasil PSC dari ubur-ubur Rhopilema asamushi18 dilaporkan sejumlah 35,2% (berdasarkan berat kering terliofilisasi). Selain itu, kolagen memiliki ikatan silang kovalen intermolekul yang kuat di daerah telopeptida (ujung non-heliks) dari struktur tripel-heliks yang tidak dapat diputus hanya dengan asam asetat saja sehingga enzim spesifik seperti pepsin (paling banyak digunakan), tripsin, papain, alkali protease, bromelain, pankreatik, bromelain kolagenase, atau alkalase dapat ditambahkan untuk meningkatkan kelarutan dan rendemen kolagen6,16.
Inaktivasi enzim penting dilakukan untuk membatasi aktivitas enzim atau protein pilihan dengan cara mengubah pH larutan ekstrak. Enzim yang aktif dalam pH asam, digunakan buffer tris pada supernatan untuk menaikkan ke pH 7 (inaktivasi pada pH ≥ 7). Dengan demikian, kolagen tidak akan terdegradasi lebih lanjut. Selain itu, inaktivasi enzim juga dapat dilakukan dengan mendialisis larutan ekstrak terhadap larutan buffer,
misal buffer natrium fosfat untuk ekstrak asam13. Larutan ekstrak digarami dan endapan yang dihasilkan dikumpulkan dengan sentrifugasi atau ultrafiltrasi dan didialisis dengan larutan buffer diikuti dengan air suling dan kemudian diliofilisasi. Untuk meminimalkan degradasi protein, semua prosedur dilakukan pada suhu 4°C19. Ada banyak metode
ekstraksi kolagen yang dikenal dimana masing-masing metode memiliki keterbatasan. Banyak upaya difokuskan untuk mendapatkan kolagen dengan kemurnian tinggi, rendemen tinggi, integritas struktural, dan sifat khusus seperti kemampuan pembentukan gel, kemampuan penahan air, dan stabilitas termal17.
Gambar 2 menunjukkan metode yang disederhanakan untuk ekstraksi kolagen laut. Meskipun metode ini mudah dan terjangkau, tetapi pengerjaannya memerlukan waktu lama serta menggunakan banyak pelarut dan bahan baku untuk hasil yang lebih baik. Baru-baru ini, telah dilaporkan metode ekstraksi pada sponge Chondrosia reniformis menggunakan langkah ekstraksi tunggal, kondisi perlakuan ringan dan waktu yang lebih singkat (3 jam) dengan menggunakan air sebagai pelarut tunggal20. Prinsip pengerjaannya mengikuti penggunaan air bertekanan dengan karbon dioksida. Kolagen yang paling optimal dihasilkan pada vessel bertekanan tinggi (10 bar) dengan suhu 37°C dan pengadukan konstan 300 rpm selama 3 jam. Metode ini menghasilkan rendemen dengan peningkatan lebih dari 30%.
Karakteristik Biomaterial
Kolagen yang bersumber dari kulit dan tulang ikan memiliki struktur molekul yang lebih kecil dibandingkan dengan kolagen yang terbuat dari sapi atau babi sehingga lebih mudah untuk diserap21. Kolagen memiliki kapasitas penyerapan air yang tinggi sehingga menjadi komponen yang baik untuk pemberi tekstur, pengental, dan pembentuk gel. Selain itu, kolagen memiliki sifat yang berkaitan dengan perilaku permukaan seperti emulsi, pembentukan busa, stabilisasi, adhesi dan kohesi, fungsi koloid pelindung dan kapasitas pembentukan film. Kolagen adalah bahan aktif permukaan yang baik, dan memiliki kemampuan berpenetrasi pada antarmuka bebas lipid22.
Kolagen yang berasal dari hewan laut telah terbukti mirip dengan kolagen sapi dan babi dalam hal komposisi asam amino dan biokompatibilitasnya. Glisin adalah asam amino yang proporsinya lebih dari 30% dibandingkan jenis asam amino lainnnya dalam kolagen. Selain itu, proporsi asam amino hidroksil prolin berkisar 35-48% serupa pada kolagen mamalia23. Asam amino ini merupakan jenis yang penting untuk pembentukan struktur heliks spesifik kolagen dan stabilitasnya. Namun, beberapa proporsi glisin yang rendah teramati pada beberapa sumber laut seperti kolagen sponge Chondrosia reniformis mengandung 18,9% glisin dan 40% hidroksiprolin24. Spesies yang sama baru-baru ini ditemukan mengandung 31,6% glisin dan 47,3% hidroksiprolin20. Perbedaan ini dapat dijelaskan oleh fakta bahwa selain kolagen, jaringan laut mengandung protein lain seperti glikoprotein yang diketahui sangat terkait dengan kolagen dan muncul sebagai pengotor sehingga mempengaruhi kemurnian kolagen yang diekstraksi. Selain itu, hal tersebut bisa disebabkan oleh beberapa perbedaan struktural dan kimia antara sumber, metode ekstraksi dan analisis biokimia yang dilakukan peneliti24. Oleh karena itu, untuk mendapatkan hasil yang konsisten, kondisi yang diatur ketat perlu diterapkan untuk persiapan dan pelestarian sampel sebelum dilakukan ekstraksi.
Berdasarkan kategorinya sebagai biomaterial, termostabilitas adalah salah satu parameter penting yang perlu dipertimbangkan. Beberapa kolagen dari sumber laut diketahui memiliki suhu denaturasi di bawah suhu fisiologis manusia normal (37°C). Sebagai contoh, gel kolagen yang berasal dari ikan salmon chum (Oncorhynchus keta) terdenaturasi pada 19°C sedangkan kolagen hiu terdenaturasi sekitar 30°C. Ketidakstabilan suhu ini membuat beberapa biomaterial turunan kolagen sulit untuk dipraktikkan terutama untuk aplikasi medis manusia16. Termostabilitas kolagen laut telah terbukti ditingkatkan dengan pengikatan silang kimia kolagen dengan senyawa kimia lainnya seperti karbondiimida, 1-etil 3-(3-dimetilaminopropil)-karbodiimida, glikosami-noglikan, dan glutaraldehid. Proses ini terbukti meningkatkan suhu denaturasi kolagen ikan salmon chum (Oncorhynchus keta) menjadi 55°C. Studi in vitro dapat dilakukan sebagai simulasi penggunaan secara klinis23. Selain itu, penggunaan ikatan silang secara kimiawi telah dilakukan dalam mengembangkan kolagen laut menjadi biomaterial seperti gel, sponge, film, scaffold, komposit dan membran. Gel kitosan dapat digunakan sebagai pengisi jaringan dan penghantaran obat. Scaffold kolagen meningkatkan interaksi sel, untuk mengontrol pelepasan growth factor dalam sistem penghantaran obat16. Meskipun ikatan silang kimia memberikan stabilitas tinggi pada matriks kolagen, tetapi dapat berakibat pada potensi sitotoksisitas dan/ atau biokompatibilitas yang buruk23.
Aplikasi dalam Sistem Penghantaran Obat
Sistem pengahantaran obat didefinisikan sebagai sistem yang digunakan sebagai media atau pembawa dalam memberikan obat kepada pasien hingga dicapai efek terapeutik. Daya tarik kolagen sebagai biomaterial sebagian besar karena memiliki imunogenisitas rendah dan diterima oleh tubuh sebagai konstituen normal daripada benda asing. Kolagen dapat diproses menjadi beberapa bentuk seperti film, tube, sponge, serbuk, larutan dan dispersi injeksi, yang digunakan dalam praktik medis25. Penghantaran bahan aktif farmasi berukuran besar masih menjadi tantangan besar, termasuk ketidakstabilan in vivo, rendahnya bioavailabilitas, kelarutan, dan rendahnya absorpsi kedalam jarigan tubuh dengan penghantaran spesifik tertarget dan efektifitas tonisitas, dan kemungkinan efek merugikan yang timbul26. Beberapa penelitian melaporkan penggunaan kolagen sebagai carrier dalam berbagai sistem penghantaran obat dalam berbagai aplikasi seperti pelepasan terkontrol protein/ hormon, penyembuhan luka bakar, peningkatan bioavailabilitas obat melalui dermal dan oral, pengobatan tumor dan pelepasan obat sensitif pH.
1. Sistem Partikulat
Para peneliti telah mengembangkan sistem penghantaran protein mikropartikulat menggunakan kolagen dari medusa Catostylus tagi27. Kolagen ubur-ubur digunakan sebagai matriks polimer untuk membentuk mikropartikel kolagen dengan menggunakan metode ekstraksi pelarut emulsifikasi-gelasi-pelarut. Sambung silang yang tinggi dalam matriks kolagen memerangkap protein terapeutik dan mengontrol pelepasannya dari sistem dengan aktivitas biologis yang dipertahankan. Studi in vitro menunjukkan potensi penggunaan kolagen laut dalam pembuatan mikropartikel untuk pelepasan terkontrol protein terapeutik.
Sebuah studi telah dilakukan dalam mengembangkan nanopartikel kolagen spons Chondrosia reniformis sebagai peningkat penetrasi untuk penghantaran 7β-estradiol-hemihidrat dalam terapi penggantian hormon secara transdermal28. Partikel nano-kolagen dibuat dengan hidrolisis alkali terkontrol, lalu estradiol diadsorpsi pada permukaannya dan diformulasikan kedalam hidrogel. Hidrogel dengan nanopartikel kolagen ini memungkinkan perpanjangan pelepasan estradiol dibandingkan gel komersil sehingga menghasilkan absorpsi estradiol yang lebih baik. Selain itu, mikropartikel kolagen yang berasal dari spons Chondrosia reniformis dibuat dengan emulsifikasi dan ikatan silang kolagen dan dimuat all-trans retinol sebagai obat. Mikropartikel kolagen-retinol tersebut diformulasikan dalam hidrogel dan diuji stabilitasnya serta dilakukan perbandingan uji penetrasi in vitro pada kulit tikus dengan formula retinol tanpa mikropartikel. Hasilnya mikropartikel kolagen-retinol tidak memiliki pengaruh pada stabilitas kimia retinol dalam hidrogel dan penetrasi retinol ke dalam kulit meningkat signifikan menjadi dua kali lipatnya29.
Penelitian lain melaporkan metode sederhana untuk menyiapkan core-shell MCP kalsium/nanopartikel kalsium alginat dengan diameter sekitar 400 nm menggunakan MCP yang diproduksi dari sisik ikan Synodontidae dan kalsium alginat untuk enkapsulasi kalsium30. Eksperimen in vivo menunjukkan bahwa nanopartikel terkhelasi berbasis MCP kalsium yang diberikan secara intragastri meningkatkan penyerapan kalsium dan mencegah defisiensi kalsium dan juga meningkatkan kepadatan mineral tulang femur dan kandungan kalsium pada tikus, menyatakan bahwa nanopartikel berbasis MCP dapat menjadi pembawa ideal untuk digunakan dalam suplementasi kalsium.
2. Film
Pada laporan lainnya, telah dikembangkan dressing berbahan dasar kolagen laut untuk pemberian obat topikal. Kolagen sponge laut (Porifera, Dictyoceratida) dikarakterisasi dan dibuat menjadi film polimer yang mengandung L-sistein hidroklorida untuk penyembuhan luka12. Studi in vitro menunjukkan bahwa sistein dalam biopolimer dilepaskan lebih lambat di lokasi luka daripada obat murni. Hal ini membuat sistem ini menarik untuk penghantaran obat berbasis bio-kolagen laut karena menggabungkan sifat penyembuhan sistein dengan potensi kolagen/ proteoglikan sebagai pembawa biokompatibel yang mampu menyerap eksudat luka berlebih saat melepaskan obat. Selain itu, kandungan glikosaminoglikannya menyebabkan kolagen penyusun dressing bertindak sebagai pembawa bioaktif-biomimetik yang mengatur proses penyembuhan luka.
Pengembangan desain lainnya dibuat sistem penghantaran menggunakan kolagen peptida fish-scale yang terkonjugasi dengan poli (3-hidroksibutirat-co-4-hidroksibutirat/ P(3HB-co-4HB)) melalui aminolisis untuk membentuk scaffold film yang hidrofilik sebagai dressing31. Peningkatan hidrofilisitas film meningkatkan proliferasi sel dan mempercepat penyembuhan luka. Studi in vivo menunjukkan bahwa scaffold P(3HB-co-4HB)/kolagen dapat meningkatkan proliferasi sel fibroblast dan mempercepat laju penutupan luka dengan laju degradasi yang tinggi. Hal itu membuktikan bahwa sistem tersebut menunjukkan potensi penggunaannya untuk dressing luka dan sistem penghantaran obat.
3. Gel dan Hidrogel
Kesesuaian gel dan film kolagen yang disintesis menggunakan ASC dan PSC dari kulit belut (Evenchelys macrura) diuji untuk menghantarkan ampisilin dan tetrasiklin. Hasil menunjukkan bahwa gel dan film kolagen ini dapat digunakan sebagai pembawa efisien untuk obat antibakteri dan antijamur untuk digunakan dalam sistem penghantaran obat32. Gel kitosan/kolagen laut injeksi yang disuntikkan telah dikembangkan menggunakan atelokolagen dari kulit segar, tulang, dan sisik-sisik ikan chum salmon (Oncorhynchus keta) dan diinjeksi secara subkutan pada tikus. Hasil pengamatan menunjukkan bahwa sel inflamasi menginfiltrasi dan melepaskan TNF-α sehingga nekrosis tumor berhasil dikendalikan. Selain itu, gel yang disuntikkan telah diganti
dengan jaringan fibrosa yang terdiri dari fibrosa dan ECM, menunjukkan gel komposit ini bisa menjadi pembawa yang cocok untuk pengisi jaringan dan sistem penghantaran obat33.
4. Tablet salut enterik
Pengembangan tablet salut dengan menggunakan kolagen laut sponge Chondrosia reniformis untuk pelepasan tertunda telah dilakukan. Dispersi penyalut berbahan kolagen laut disiapkan dan dilapiskan pada tablet agar tahan terhadap paparan asam lambung. Hasilnya disintegrasi semua tablet terjadi pada larutan dapar fosfat pH 6,8. Hal itu menunjukkan kecocokan sebagai salut enterik tablet serta memberikan sifat mekanik dan stabilitas penyimpanan yang baik34.
5. Sponge
Sponge kolagen berpori dibuat dari ikan scales (Lates calcarifer) yang digabungkan dengan ekstrak Macrotyloma uniflorum untuk memberikan aktivitas antimikroba kedalam sponge35. Sponge kolagen ini menunjukkan biokompatibilitas yang sangat baik dalam kultur fibroblast tikus (NIH3T3) dan keratinosit manusia (HaCaT). Hasil pengamatan menunjukkan bahwa sponge merupakan kandidat potensial untuk dressing luka atau luka bakar.
Kesimpulan
Kolagen laut dapat menjadi sumber alternatif selain kolagen sapi dan babi. Peptida kolagen yang berasal dari kolagen laut telah terbukti menunjukkan aktivitas biologis yang menarik. Resistensi dari beberapa peptida turunan kolagen terhadap pencernaan gastrointestinal, dan kemampuannya dalam mencapai aliran darah menunjukkan bahwa kolagen laut dapat menjadi sumber peptida bioaktif dalam penghantaran obat. Pengembangan sistem penghantaran obat lainnya dengan pemanfaatan kolagen yang bersumber dari keanekaragaman hayati perikanan dan kelautan Indonesia menjadi peluang dan tantangan bagi para peneliti di masa yang akan datang.
Daftar pustaka
- Felician F.F., Xia C., Qi W., Xu H. Collagen from Marine Biological Sources and Medical Applications. Chem Biodivers. 2018;15(5).
- Venkatesan J., Anil S., Kim S.K., Shim M.S. Marine fish proteins and peptides for cosmeceuticals: A review. Mar Drugs. 2017;15(5):1–18.
- Yang H., Wang H., Zhao Y., Wang H., Zhang H. Effect of heat treatment on the enzymatic stability of grass carp skin collagen and its ability to form fibrils in vitro. J Sci Food Agric. 2015;95(2):329–36.
- Barzideh Z., Latiff A.A., Gan C.Y., Benjakul S., Karim A.A. Isolation and characterisation of collagen from the ribbon jellyfish (Chrysaora sp.). Int J Food Sci Technol. 2014;49(6):1490–9.
- Pozzolini M., Bruzzone F., Berilli V., Mussino F., Cerrano C., Benatti U., et al. Molecular Characterization of a Nonfibrillar Collagen from the Marine Sponge Chondrosia reniformis Nardo 1847 and Positive Effects of Soluble Silicates on Its Expression. Mar Biotechnol. 2012;14(3):281–93.
- Silva T.H., Moreira-Silva J., Marques A.L.P., Domingues A., Bayon Y., Reis R.L. Marine origin collagens and its potential applications. Mar Drugs. 2014;12(12):5881–901.
- Hadzik J., Kubasiewicz-Ross P., Kunert-Keil C., Jurczyszyn K., Nawrot-Hadzik I., Dominiak M., et al. A silver carp skin derived collagen in bone defect treatment—A histological study in a rat model. Ann Anat. 2016;208:123–8.
- Sorushanova A., Delgado L.M., Wu Z., Shologu N., Kshirsagar A., Raghunath R., et al. The Collagen Suprafamily: From Biosynthesis to Advanced Biomaterial Development. Adv Mater. 2019;31(1):1–39.
- Zhuang Y.L., Zhao X., Li B.F. Optimization of antioxidant activity by response surface methodology in hydrolysates of jellyfish (Rhopilema esculentum) umbrella collagen. J Zhejiang Univ Sci B. 2009;10(8):572–9.
- Cheng X., Shao Z., Li C., Yu L., Raja M.A., Liu C. Isolation, characterization and evaluation of collagen from jellyfish Rhopilema esculentum kishinouye for use in hemostatic applications. PLoS One. 2017;12(1):1–21.
- Khong N.M.H., Yusoff F.M., Jamilah B., Basri M., Maznah I., Chan K.W., et al. Nutritional composition and total collagen content of three commercially important edible jellyfish. Food Chem. 2016;196:953–60.
- Langasco R., Cadeddu B., Formato M., Lepedda A.J., Cossu M., Giunchedi P., et al. Natural collagenic skeleton of marine sponges in pharmaceutics: Innovative biomaterial for topical drug delivery. Mater Sci Eng C. 2017;70:710–20.
- Wichuda J., Sunthorn C., Busarakum P. Comparison of the properties of collagen ex tracted from dried jellyfish and dried squid. African J Biotechnol. 2016;15(16):642–8.
- Nagai T., Suzuki N., Nagashima T. Collagen from common minke whale (Balaenoptera acutorostrata) unesu. Food Chem. 2008;111(2):296–301.
- Astiana I., Nurjanah N., Nurhayati T. Characterization of Acid Soluble Collagen from Redbelly Yellowtail Fusilier Fish Skin (Caesio cuning). J Pengolah Has Perikan Indones. 2016;19(1):79–93.
- Ehrlich H., Deutzmann R., Brunner E., Cappellini E., Koon H., Solazzo C., et al. Mineralization of the metre-long biosilica structures of glass sponges is templated on hydroxylated collagen. Nat Chem. 2010;2(12):1084–8.
- Schmidt M.M., Dornelles R.C.P., Mello R.O., Kubota E.H., Mazutti M.A., Kempka A.P., et al. Collagen extraction process. Int Food Res J. 2016;23(3):913–22.
- Nagai T., Worawattanamateekul W., Suzuki N., Nakamura T., Ito T., Fujiki K., et al. Isolation and characterization of collagen from rhizostomous jellyfish (Rhopilema asamushi). Food Chem. 2000;70(2):205–8.
- Zhang J., Duan R., Huang L., Song Y., Regenstein J.M. Characterisation of acid-soluble and pepsin-solubilised collagen from jellyfish (Cyanea nozakii Kishinouye). Food Chem. 2014;150:22–6.
- Silva J.C., Barros A.A., Aroso I.M., Fassini D., Silva T.H., Reis R.L., et al. Extraction of Collagen/Gelatin from the Marine Demosponge Chondrosia reniformis (Nardo, 1847) Using Water Acidified with Carbon Dioxide-Process Optimization. Ind Eng Chem Res. 2016;55(25):6922–30.
- Hemanth Kumar M., Spandana V., Poonam T.. Extraction and Determination of Collagen Peptide and Its Clinical Importance from Tilapia Fish Scales (Oreochromis Niloticus). Vol. 2, Research Journal of Pharmacy. 2011.
- Hashim P., Mohd Ridzwan M.S., Bakar J., Mat Hashim D. Collagen in food and beverage industries. Int Food Res J. 2015;22(1):1–8.
- Yamada S., Yamamoto K., Ikeda T., Yanagiguchi K., Hayashi Y.. Potency of fish collagen as a scaffold for regenerative medicine. Biomed Res Int. 2014;2014(3).
- Swatschek D., Schatton W., Kellermann J., Müller W.E.G., Kreuter J. Marine sponge collagen: Isolation, characterization and effects on the skin parameters surface-pH, moisture and sebum. Eur J Pharm Biopharm. 2002;53(1):107–13.
- Friess W. Collagen-Biomaterial for drug delivery. Eur J Pharm Biopharm. 1998;45(2):113–36.
- Lim Y., Ok Y., Hwang S., Kwak J., Yoon S.. Applications Marine Collagen as A Promising Biomaterial for. 2019;
- Calejo M.T., Almeida A.J., Fernandes AI. Exploring a new jellyfish collagen in the production of microparticles for protein delivery. J Microencapsul. 2012;29(6):520–31.
- Nicklas M., Schatton W., Heinemann S., Hanke T., Kreuter J. Preparation and characterization of marine sponge collagen nanoparticles and employment for the transdermal delivery of 17β-estradiol-hemihydrate SCNPs for dermal delivery of estradiol. Drug Dev Ind Pharm. 2009;35(9):1035–42.
- Swatschek D., Schatton W., Müller W.E.G., Kreuter J. Microparticles derived from marine sponge collagen (SCMPs): preparation, characterization and suitability for dermal delivery of all-trans retinol. Eur J Pharm Biopharm. 2002;54(2):125–33.
- Guo H., Hong Z., Yi R. Core-Shell Collagen Peptide Chelated Calcium/Calcium Alginate Nanoparticles from Fish Scales for Calcium Supplementation. J Food Sci. 2015;80(7):N1595–601.
- Vigneswari S., Murugaiyah V., Kaur G., Abdul Khalil H.P.S., Amirul A.A. Biomacromolecule immobilization: Grafting of fish-scale collagen peptides onto aminolyzed P(3HB-co-4HB) scaffolds as a potential wound dressing. Biomed Mater. 2016;11(5):55009.
- Veeruraj A., Arumugam M., Ajithkumar T., Balasubramanian T. Isolation and characterization of drug delivering potential of type-I collagen from eel fish Evenchelys macrura. J Mater Sci Mater Med. 2012;23(7):1729–38.
- Wang W., Itoh S., Aizawa T., Okawa A., Sakai K., Ohkuma T., et al. Development of an injectable chitosan/marine collagen composite gel. Biomed Mater. 2010;5(6).
- Nicklas M., Schatton W., Heinemann S., Hanke T., Kreuter J. Enteric coating derived from marine sponge collagen Enteric coating derived from marine sponge collagen. Drug Dev Ind Pharm. 2009;35(11):1384–8.
- Muthukumar T., Prabu P., Ghosh K., Sastry T.P. Fish scale collagen sponge incorporated with Macrotyloma uniflorum plant extract as a possible wound/burn dressing material. Colloids Surfaces B Biointerfaces. 2014;113:207–12.
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3