Majalah Farmasetika, 7 (2) 2022, 165-172 https://doi.org/10.24198/mfarmasetika.v7i2.37343
Artikel Penelitian
Download PDF
Patihul Husni1*, La Ode Zahid Al Hajri Nur Salam2, GinayantiHadisoebroto2
1Departemen Farmasetika dan Teknologi Farmasi, Fakultas Farmasi, Universitas Padjadjaran, Jatinangor, Indonesia
2Program Studi Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Al-Ghifari, Bandung, Indonesia
*Email:patihul.husni@unpad.ac.id
(Submit 23/12/2021, Revisi 19/01/2022, Diterima 18/12/2022, Terbit 03/03/2022)
Abstrak
Pasien anak biasanya mendapatkan sediaan obat mengandung parasetamol dalam bentuk sediaan drops atau sirup karena sulitnya anak kecil meminum obat dalam bentuk tablet atau kaplet. Pemberian obat parasetamol pada anak terkadang dicampur dengan minuman teh manis untuk menutupi rasa pahit dari obat tersebut. Pencampuran ini berpotensi menimbulkan interaksi antara parasetamol dan komponen yang terdapat dalam minuman teh manis tersebut. Tujuan dari penelitian ini adalah untuk menentukan stabilitas kadar parasetamol dalam bentuk sediaan drops yang dicampur dengan minuman teh manis. Metode yang dilakukan adalah mencampur parasetamol drops dengan minuman teh manis dan disimpan pada kondisi penyimpanan suhu ruang (≤ 30 ⁰C) dan suhu dingin (2-8 ⁰C). Pada interval waktu 0, 5, 10, 15, 20, 30, 45, 60, 120, 180 dan 1440 menit dilakukan pengamatan organoleptik dan penetapan kadar parasetamol menggunakan Spektrofotometri UV-Vis. Hasil pengujian organoleptik menunjukkan campuran stabil berbentuk cair berwarna merah dengan aroma khas parasetamol dan sedikit aroma teh selama 24 jam penyimpanan pada suhu dingin. Akan tetapi, perubahan aroma terjadi pada penyimpanan 24 jam suhu ruang. Pada penyimpanan suhu dingin, kadar yang terukur setelah 3 dan 24 jam berturut-turut sebesar 65,606±0,439% dan 33,275±0,334% sedangkan penyimpanan pada suhu ruang hanya bertahan sampai 3 jam dengan kadar sebesar 60,359±0,082%. Tidak ada perbedaan yang berarti untuk penurunan kadar parasetamol drops yang dicampur minuman teh manis pada kedua kondisi penyimpanan. Berdasarkan hasil tersebut dapat disimpulkan bahwa pencampuran parasetamol drops dengan minuman teh manis akan mempengaruhi stabilitas kadar parasetamol yaitu menyebabkan penurunan kadar parasetamol walaupun tidak ada perbedaan kadar yang berarti antara penyimpanan pada suhu ruang dan suhu dingin.
Kata Kunci
studi stabilitas, kadar, parasetamol, drops
Pendahuluan
Demam merupakan keadaan dimana terjadi peningkatan suhu normal tubuh (36,5-37,5 ⁰C). Demam yang tinggi perlu segera ditanggulangi karena akan berakibat kejang dan kerusakan organ. Obat pilihan yang sering digunakan untuk mengatasi demam adalah parasetamol1. Parasetamol merupakan obat penurun panas dan pereda nyeri yang telah lama dikenal oleh masyarakat Indonesia. Metabolit Fenasetin ini diklaim sebagai zat antinyeri yang paling aman sebagai swamedikasi2. Parasetamol cenderung aman ketika digunakan sesuai dengan takarannya dan dapat menimbulkan hepatotoksik pada pemakaian lebih dari 4 gram atau seseorang yang beresiko terkena hepatotoksik2, 3.
Parasetamol adalah obat yang digunakan sebagai analgesik (pereda nyeri) dan antipiretik (penurun panas/demam) yang bisa diperoleh tanpa resep dokter4-6. Parasetamol drops merupakan suatu sediaan yang biasanya ditujukan kepada anak-anak5. Mulai dari umur 0 bulan sampai sampai 3 tahun. Drops hampir sama dengan sirup, yang membedakan adalah pemberiannya, yaitu dengan menggunakan pipet tetes. Drops ini memudahkan anak-anak untuk menelan obat.
Parasetamol memiliki rasa yang sangat pahit7. Agar sediaan parasetamol dapat disukai oleh anak-anak, maka parasetamol ditambahkan pemanis untuk menutupi rasanya8. Selain itu, penyalutan kristal parasetamol dan pengunaan eksipien-eksipien dilakukan untuk menutupi rasa pahit dari parasetamol tersebut9, 10. Meski demikian, rasa pahit tersebut tidak sepenuhnya bisa ditutupi sehingga terkadang orang tua mencampurkan parasetamol drops ke dalam makanan atau minuman seperti teh manis untuk menutupi rasa pahit dari obat tersebut. Hal ini sebenarnya tidak dianjurkan sebab obat dapat berinteraksi dengan dengan makanan atau minuman tersebut. Perubahan efek obat akibat interaksi tersebut dapat saja membahayakan dengan meningkatnya toksisitas obat atau berkurangnya khasiat obat11. Penelitian ini bertujuan untuk menentukan stabilitas kadar parasetamol dalam bentuk sediaan drops yang dicampur dengan minuman teh manis dengan kondisi penyimpanan pada suhu ruang (≤ 30 ⁰C) dan suhu dingin (2-8 ⁰C). Urgensi penelitian ini adalah untuk memberikan informasi dan data ilmiah mengenai stabilitas kadar parasetamol yang dicampur minuman teh manis baik yang disimpan pada suhu ruang (≤ 30 ⁰C) maupun suhu dingin (2-8 ⁰C).
Metode
Penelitian ini menggunakan metode eksperimental di laboratorium meliputi pengumpulan bahan penelitian, penyiapan sampel, pembuatan kurva baku, validasi metode analisis, dan uji stabilitas dan penetapan kadar sampel uji stabilitas. Penelitian ini dilakukan di Laboratorium Instrumen, Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Universitas Al-Ghifari, Bandung, Jawa Barat.
Pengumpulan bahan penelitian
Bahan-bahan yang digunakan yaitu teh celup dan sediaan parasetamol drops diperoleh dari pasaran. Baku pembanding parasetamol diperoleh dari Instalasi Pengawasan Mutu, Lembaga Farmasi Pusat Kesehatan Angkatan, Bandung, Jawa Barat. Metanol, aquadest, dan larutan pereaksi lainnya diperoleh dari Laboratorium Instrumen, Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Universitas Al-Ghifari, Bandung, Jawa Barat.
Penyiapan sampel
Minuman teh manis dibuat dengan cara menyeduh 1 kantong teh celup dengan 200 mL air hangat di dalam gelas dan ditambahkan 1 sendok makan gula pasir sambil diaduk sampai semua butiran gula terlarut dan larutan berwarna kecoklatan. Larutan ini dibiarkan dingin pada suhu ruang. Sampel uji stabilitas disiapkan dengan mencampurkan parasetamol drops dan minuman teh manis dengan perbandingan 1:1 di dalam vial dan dicampur homogen. Banyaknya campuran disesuaikan dengan jumlah total sampel yang dibutuhkan untuk satu kali penetapan kadar. Sampel disiapkan masing-masing dalam wadah yang diberi label sesuai interval waktu pengambilan sampel dan suhu uji stabilitas. Masing-masing sampel dibuat triplo.
Kondisi studi stabilitas
Sampel uji stabilitas disimpan pada suhu ruang (≤ 30 °C) dan suhu dingin (2-8 °C). Pada interval waktu 0, 5, 10, 15, 20, 30, 45 menit dan 1, 2, 3, dan 24 jam dilakukan pengamatan secara organoleptis dan ditetapkan kadar parasetamol dalam sampel menggunakan spektrofotometri UV-Vis. Jika terjadi perubahan/kerusakan fisik dari campuran seperti campuran mengalami perubahan aroma dan lain sebagainya yang dinilai sebagai kerusakan fisik dari sampel maka penetapan kadar parasetamol dalam campuran tidak dilakukan.
Pembuatan Kurva Baku
10 mg baku pembanding parasetamol dilarutkan dengan pelarut campuran metanol dan aquadest (1:99) di dalam labu ukur 100 ml. Ambil 1 ml dan masukkan ke dalam labu ukur 10 ml lalu tambahkan pelarut sampai tanda batas dan kocok sampai larut. Larutan tersebut digunakan untuk membuat larutan baku berbagai konsentrasi yaitu 2, 4, 6, 8, 10 dan 12 ppm. Panjang gelombang maksimum parasetamol ditentukan dengan mengukur serapan larutan tersebut pada panjang gelombang 200-400 nm menggunakan Spektrofotometri UV-Vis. Masing-masing larutan diukur pada panjang gelombang maksimum yang didapatkan dan ditentukan persamaan garis linier y = bx + a menggunakan data konsentrasi (ppm) dan serapan.
Uji stabilitas dan penetapan kadar sampel uji stabilitas
Ambil 1 ml pada campuran parasetamol drops dan teh manis yang telah disimpan sesuai interval waktu dan suhu berbeda lalu masukkan ke tabung eppendorf, tambahkan 5 ml metanol dan kocok sampai homogen. Kemudian sentrifugasi selama 15 menit dengan kecepatan 70 rpm. Ambil 1 ml larutan bening dari hasil sentrifugasi dan masukkan ke labu ukur 10 ml tambahkan pelarut sampai tanda batas dan kocok sampai homogen. Ambil 0,05 ml ke dalam labu ukur 10 ml dan tambahkan pelarut sampai tanda batas dan larutkan sampai homogen. Diukur serapan larutan sampel menggunakan Spektrofotometri UV-Vis pada panjang gelombang maksimum yang telah didapatkan sebelumnya. Kadar parasetamol dihitung menggunakan kurva baku yang telah didapat.
Validasi Metode
Presisi
Presisi adalah suatu pengukuran kedekatan nilai data satu dengan data yang lainnya dalam suatu pengukuran dalam kondisi analisis yang sama. Presisi sering diukur sebagai persen Relative Standard Deviation (RSD) atau Coefficient of Standard untuk sejumlah sampel yang berbeda bermakna secara statistik12. Kriteria presisi diberikan jika metode memberikan nilai (CV) 2% atau kurang.
Akurasi
Akurasi ditentukan dengan membuat konsentrasi 6, 8 dan 10 ppm. Masing-masing diukur dan dilakukan pengulangan sebanyak 3 kali. Serapan diukur pada panjang gelombang maksimum dan kemudian dihitung persentase perolehan kembali.
Hasil
Hasil pencampuran parasetamol drops dan teh manis menunjukkan hasil yang homogen. Hasil pengamatan organoleptik terhadap hasil pencampuran meliputi bentuk, aroma dan warna sesuai dengan interval waktu penyimpanan yang telah ditentukan tertera pada Tabel 1.
Tabel 1. Hasil Pengamatan Organoleptik Sampel (n = 3)


Berdasarkan pengamatan organoleptik yang telah dilaksanakan, seluruh sampel yang disimpan pada suhu ruang dan suhu dingin menunjukkan bentuk cair, aroma khas parasetamol dan sedikit aroma teh, dan berwarna merah. Hasil pengamatan menunjukkan organoleptik campuran yang stabil kecuali pada interval 24 jam suhu ruang yang aromanya berubah yang kemungkinan disebabkan oleh rusaknya sampel.
Penetapan panjang gelombang maksimum dilakukan dengan membuat larutan standar dalam berbagai konsentrasi menggunakan pelarut methanol:air (1:99). Penggunaan metanol sebagai pelarut karena parasetamol larut dalam metanol13. Selain itu, diketahui metanol memiliki serapan panjang gelombang di bawah 210 nm14, 15. Sehingga metanol akan meneruskan atau tidak akan menyerap sinar dengan panjang gelombang di atas 210 nm. Akibatnya metanol tidak akan mengganggu spektrum serapan dari parasetamol16. Penentuan panjang gelombang pada penelitian ini dilakukan dengan mengukur absorbansi dari parasetamol pada panjang gelombang ultraviolet (200-400 nm). Hasil penelitian menunjukkan bahwa diperoleh panjang gelombang maksimum sebesar 240,4 nm (Gambar 1).

Penentuan linearitas dilakukan dengan membuat kurva kalibrasi. Linearitas merupakan kemampuan metode untuk mendatangkan hasil uji yang secara langsung sebanding dengan konsentrasi analit dalam suatu rentang kerja yang diberikan17. Hal ini dapat dilakukan dengan cara membuat kurva kalibrasi dari beberapa set larutan standar yang telah diketahui konsentrasinya18. Kurva kalibrasi merupakan metode standar yang dapat digunakan untuk menentukan konsentrasi suatu analit berdasarkan hukum Lambert-Beer19. Hasil absorbansi pada uji linearitas atau kurva baku terdapat pada gambar 2.

Pada penentuan kurva kalibrasi didapatkan persamaan garis y = 0,08012x + 0,00705 dan nilai koefisien kolerasi (R) = 0,99910. Nilai R yang baik adalah mendekati dan tidak lebih dari satu (0,995 ≤ r ≤ 1)20. Pembuatan kurva kalibrasi standar dilakukan dengan memplot larutan standar parasetamol (sumbu x) dan absorbansi (sumbu y), kemudian titik tersebut dihubungkan dengan garis lurus21.
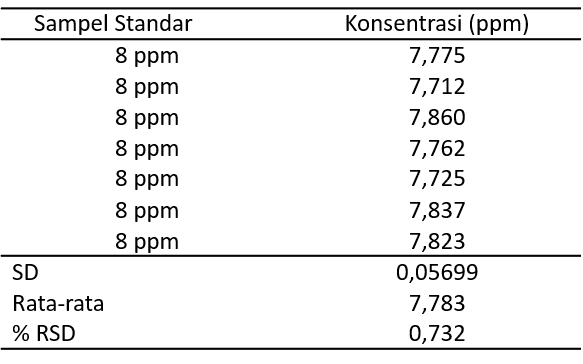
Uji presisi dilakukan dengan menggunakan larutan standar parasetamol 8 ppm sebanyak tujuh kali pengulangan. Hasil pengujian presisi pada larutan standar parasetamol menunjukkan nilai SD 0,05699 dan RSD 0,732%. Tabel 2 menunjukkan bahwa hasil yang diperoleh 0,732% dan tidak melebihi 2%. Hal ini menunjukan hasil yang baik sesuai yang ditentukan dalam persyaratan.
Tabel2. Hasil Uji Presisi
Akurasi merupakan kecermatan tingkat kedekatan hasil pengujian metode dengan nilai yang sebenarnya atau nilai yang dinyatakan benar22. Hasil uji akurasi yang diperoleh menunjukkan nilai persen perolehan kembali dari konsentrasi 4, 6 dan 8 ppm berada dalam rentang 95–105% (Tabel 3). Penentuan ketangguhan metode dilakukan dengan mengukur serapan larutan sampel pada panjang gelombang maksimum, panjang gelombang maksimum +1. Hasil uji akurasi menunjukkan nilai % recovery yang diperoleh sebesar 96,4-101,0% dan masuk dalam range yang dapat diterima yaitu 90-110% sehingga dapat dikatakan metode ini memiliki akurasi yang baik.
Tabel 3. Hasil Uji Akurasi

Data hasil penelitian sampel parasetamol drops dicampur dengan teh manis pada suhu ruang (≤ 30 ⁰C) dan suhu dingin (2-8 ⁰C) dapat dilihat pada gambar 3 yang menunjukkan bahwa parasetamol drops yang dicampur teh manis dan disimpan pada suhu ruang maupun dingin memperlihatkan penurunan kadar. Pada penyimpanan suhu dingin, kadar yang terukur setelah 3 dan 24 jam berturut-turut sebesar 65,606±0,439% dan 33,275±0,334% sedangkan penyimpanan pada suhu ruang hanya bertahan sampai 3 jam dengan kadar sebesar 60,359±0,082%. Hasil analisis statistik menggunakan uji T tidak berpasangan (α = 0,05) menunjukkan tidak terdapat perbedaan kadar yang berarti antara sampel yang disimpan pada suhu ruang dan suhu dingin. Daun teh mengandung berbagai kandungan kimia diantaranya polifenol, flavonoid, kafein, teobromin, teofilin, tannin, dan xanthine23-26. Menurut Donovan dan Devane 2001, parasetamol tidak dianjurkan dikonsumsi bersamaan dengan kafein dalam jumlah banyak seperti yang terdapat dalam minuman dan makanan misalnya kopi, teh, minuman cola, suplemen dan obat-obatan27.

Sediaan sirup parasetamol tanpa dicampur apapun menunjukkan kestabilan lebih tinggi pada suhu kamar/ruangan. Hal ini dinyatakan oleh Zulkarnain (2014) dan Rosalina (2018). Zulkarnain (2014) menyatakan bahwa sirup parasetamol yang disimpan pada suhu kamar lebih stabil dibandingkan sirup parasetamol yang disimpan pada suhu dingin dimana konsentrasi parasetamol pada suhu kamar lebih tinggi28. Selain itu, Rosalina (2018) juga menyatakan bahwa kadar parasetamol sirup dalam waktu 4 minggu stabil pada suhu ruangan dan kadar parasetamol berkurang pada penyimpanan lemari es16. Hasil yang berbeda didapatkan pada penelitian ini dimana sediaan cair parasetamol berbentuk drops dicampurkan dengan minuman teh manis disimpan pada suhu ruang dan suhu dingin dimana hasil penelitian menunjukkan penurunan kadar paling besar terjadi pada suhu ruang. Hal ini kemungkinan disebabkan oleh interaksi komponen kimia dalam minuman teh manis dengan parasetamol. Selain itu, kandungan air dalam minuman teh manis juga berperan dalam penurunan kadar parasetamol. Hidrolisis parasetamol akan menghasilkan p-aminofenol dan asam asetat (Gambar 4) 29, 30. Degradasi ini dapat dipengaruhi juga oleh panas, pH, temperatur, dan lain-lain30.

Kesimpulan
Pencampuran parasetamol drops dengan minuman teh manis yang disimpan pada suhu ruang (≤ 30 ⁰C) dan suhu dingin (2-8 ⁰C) selama interval waktu tertentu akan mempengaruhi stabilitas kadar parasetamol yaitu menyebabkan penurunan kadar parasetamol walaupun tidak ada perbedaan kadar yang berarti antara penyimpanan pada suhu ruang dan suhu dingin.
Daftar Pustaka
- Ludwig J, McWhinnie H. Antipyretic drugs in patients with fever and infection: literature review. Br J Nurs. 2019;28(10):610-8.
- Jozwiak-Bebenista M, Nowak JZ. Paracetamol: mechanism of action, applications and safety concern. Acta Pol Pharm. 2014;71(1):11-23.
- Agrawal S, Khazaeni B. Acetaminophen Toxicity. StatPearls. Treasure Island (FL)2021.
- Lubis IND, Lubis CP. Penanganan demam pada anak. Sari Pediatri. 2016;12(6):409-18.
- Daifallah A, Jabr R, Al-Tawil F, Elkourdi M, Salman Z, Koni A, et al. An assessment of parents’ knowledge and awareness regarding paracetamol use in children: a cross-sectional study from Palestine. BMC Public Health. 2021;21(1):380.
- Graham GG, Davies MJ, Day RO, Mohamudally A, Scott KF. The modern pharmacology of paracetamol: therapeutic actions, mechanism of action, metabolism, toxicity and recent pharmacological findings. Inflammopharmacology. 2013;21(3):201-32.
- Almurisi SH, Doolaanea AA, Akkawi ME, Chatterjee B, Ahmed Saeed Aljapairai K, Islam Sarker MZ. Formulation development of paracetamol instant jelly for pediatric use. Drug Dev Ind Pharm. 2020;46(8):1373-83.
- Chabib R, Rizki MI, Aprianto ZA. Pengembangan formulasi dan evaluasi gummy candies parasetamol untuk anak-anak. Jurnal Pharmascience. 2014;1(1):18-22.
- Simsic T, Nolimal B, Minova J, Baumgartner A, Planinsek O. A straw for paediatrics: How to administer highly dosed, bitter tasting paracetamol granules. Int J Pharm. 2021;602:120615.
- Walsh J, Cram A, Woertz K, Breitkreutz J, Winzenburg G, Turner R, et al. Playing hide and seek with poorly tasting paediatric medicines: do not forget the excipients. Adv Drug Deliv Rev. 2014;73:14-33.
- Rahmawati F, Handayani R, Gosal V. Kajian Retrospektif Interaksi Obat di Rumah Sakit Pendidikan Dr. Sardjito Yogyakarta. Majalah Farmasi Indonesia. 2006;17(4):177-83.
- Rao TNJC, Approaches VoAMASoC. Validation of analytical methods. 2018.
- Granberg RA, Rasmuson AC. Solubility of paracetamol in pure solvents. J Chem Eng Data. 1999;44(6):1391-5.
- Jackson B. UV Cutoff: Burdick & Jackson; [Available from: https://macro.lsu.edu/HowTo/solvents/UV%20Cutoff.htm.
- Chiralabs. UV-Vis Cut-offs: Chiralabs; [Available from: https://www.chiralabsxl.com/UV-Vis_Solvents.html.
- Rosalina V. Analisis Kadar Sedian Parasetamol Syrup Pada Anak Terhadap Lama Penyimpanan Dan Suhu Penyimpanan. WARTA BHAKTI HUSADA MULIA: Jurnal Kesehatan. 2018;5(1).
- Harmonization ICo. Q2 Validation of analytical procedures : text and methodology international conference on harmonization of technical requirements for registration of pharmaceutical for human use, ICH Harmonized Tripartite Guideline; 2005. 2005 [Available from: https://www.gmp-compliance.org/files/guidemgr/Q2(R1).pdf.
- Adeeyinwo C, Okorie N, Idowu G. Basic calibration of UV/visible spectrophotometer. International Journal of Science Technology. 2013;2(3):247-51.
- Potrich E, Amaral L. Determination of kinetic parameters of the crystal violet reaction with sodium hydroxide applying absorbance technique and the laws of Lambeert-Beer and Arrhenius. ENCICLOPÉDIA BIOSFERA. 2017;14(25).
- Chandra B, Rivai H, Apriansyah E. Pengembangan Dan Validasi Metode Analisis Propanolol Hidroklorida Tablet Dengan Metode Absorbansi Dan Luas Daerah Di Bawah Kurva Secara Spektrofotometri Ultraviolet. Jurnal Farmasi Higea. 2017;9(1):20-9.
- Aryasa IWT, Artini NPR, VA DPR, Aprilianti NKD. Penentuan Kadar Parasetamol Pada Obat Dan Jamu Tradisional Menggunakan Metode Spektrofotometri Uv/Vis. Jurnal Media Sains. 2018;2(1).
- Belouafa S, Habti F, Benhar S, Belafkih B, Tayane S, Hamdouch S, et al. Statistical tools and approaches to validate analytical methods: methodology and practical examples. International Journal of Metrology. Quality Engineering. 2017;8:9.
- Meng XH, Li N, Zhu HT, Wang D, Yang CR, Zhang YJ. Plant Resources, Chemical Constituents, and Bioactivities of Tea Plants from the Genus Camellia Section Thea. J Agric Food Chem. 2019;67(19):5318-49.
- Teixeira AM, Sousa C. A Review on the Biological Activity of Camellia Species. Molecules. 2021;26(8).
- Kochman J, Jakubczyk K, Antoniewicz J, Mruk H, Janda K. Health Benefits and Chemical Composition of Matcha Green Tea: A Review. Molecules. 2020;26(1).
- Ramdani D, Chaudhry AS, Seal CJ. Chemical composition, plant secondary metabolites, and minerals of green and black teas and the effect of different tea-to-water ratios during their extraction on the composition of their spent leaves as potential additives for ruminants. J Agric Food Chem. 2013;61(20):4961-7.
- Donovan JL, DeVane CL. A primer on caffeine pharmacology and its drug interactions in clinical psychopharmacology. Psychopharmacol Bull. 2001;35(3):30-48.
- Zulkarnain I. Stabilitas Kimia Dan Usia Simpan Sirup Parasetamol Pada Berbagai Suhu Penyimpanan. Jurnal Ilmiah As-Syifaa. 2014;6(1):17-24.
- Feng XW, Zhang QH, Cong PS, Zhu ZL. Determination of the paracetamol degradation process with online UV spectroscopic and multivariate curve resolution-alternating least squares methods: comparative validation by HPLC. Anal Methods-Uk. 2013;5(19):5286-93.
- Ayyash F, Kamis M, Khalaf S, Thawabteh A, Karaman R. Removal of Aspirin, Salicylic Acid, Paracetamol and p-Aminophenol by Advanced Membrane technology Activated Charcoal and Clay Micelles Complex. International Case Studies Journal. 2015;4.
Cara mengutip artikel ini
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3

