Majalah Farmasetika, 9 (4) 2024, 388-428
https://doi.org/10.24198/mfarmasetika.v9i4.56043
Artikel Review
Ramadhania Ariza Putri,1, Santi Rukminita Anggraeni*,2, Soraya Ratnawulan Mita3
1Program Studi Ilmu Kelautan, Fakultas Perikanan dan Ilmu Kelautan Universitas Padjajaran
2 Pusat Studi Konservasi dan Pengelolaan Kawasan Maritim, Universitas Padjajaran
3Departemen Farmasetika dan Teknologi Farmasi, Fakultas Farmasi, Universitas Padjajaran
Jl. Raya Bandung Sumedang KM.21, Jatinangor, Sumedang. Jawa Barat 45363 Indonesia
*E-mail : santi.rukminita@unpad.ac.id
(Submit 05/07/2024, Revisi 01/08/2024, Diterima 12/08/2024, Terbit 14/08/2024)
Abstrak
Produk kosmetik yang mengandung bahan alami memberi lebih banyak khasiat, sehingga membuat konsumen lebih memilih produk dengan kandungan bahan alami. Industri kecantikan akan menjadi salah satu penggerak ekonomi paling utama karena Indonesia merupakan negara dengan populasi terbanyak ke-4 di dunia. Selain itu, potensi dan kekayaan alam di Indonesia juga mendukung perusahaan kosmetik luar dan dalam negeri untuk mengembangkan produk kosmetik dan skin care yang natural yang berkualitas. Senyawa alami digunakan sebagai bahan kosmetik memiliki keuntungan yang lebih banyak dibanding komposisi yang ada pada produk kosmetik pada umumnya, karena biasanya lebih ramah lingkungan, tidak beracun, tidak bersifat karsinogenik, lebih mudah didapatkan, dan lebih menguntungkan perekonomian Salah satu spesies alga merah (Rhodophyta) yang banyak dibudidayakan di Indonesia adalah Eucheuma spinosum. Spesies ini dapat dibudidayakan di banyak daerah perairan Indonesia, seperti Nusa Tenggara Barat, Jawa Timur, Kalimantan Barat, hingga Riau. Contoh senyawa yang dapat dihasilkan E. spinosum adalah iota carrageenan, pigmen alga (karotenoid), flavonoid, senyawa fenolik, alkaloid, triterpenoid, steroid, tanin, dan saponin. Senyawa tersebut memiliki berbagai potensi di bidang kosmetik, misalnya sebagai senyawa antioksidan, antibakteri, senyawa fotoprotektif, bahan pelembab kulit, senyawa anti-tyrosinase, anti-aging dan agen pembentuk gel atau stabilisator pada produk kosmetik.
Kata kunci: Alga merah, Eucheuma spinosum, Kosmetik, Skin care
Teks Lengkap:
Pendahuluan
Bahaya kandungan aktif dalam produk perawatan kulit membuat konsumen menjadi lebih hati-hati dalam memilih produk kecantikan untuk dikonsumsi. Konsumen menjadi lebih paham mengenai bahan yang berbahaya, sehingga menghindari membeli produk tersebut dan cenderung memilih produk yang memiliki jaminan penggunaan bahan organik atau natural1,2. Untuk menghadapi tantangan tersebut, banyak perusahaan bidang kecantikan yang menghadirkan kandungan bahan natural pada produk perawatan kulit. Produk kosmetik yang mengandung bahan alami memberi lebih banyak khasiat, sehingga membuat konsumen lebih memilih produk dengan kandungan bahan alami3,4. Bahan alami yang sudah banyak digunakan untuk menjadi komposisi produk kecantikan biasanya berasal dari tumbuhan, baik itu tumbuhan terrestrial maupun tumbuhan akuatik. Adapun tumbuhan akuatik yang bisa digunakan adalah rumput laut atau alga.
Produk berbahan dasar alga sudah banyak digunakan sebagai kosmetik dan obat-obatan. Hal itu disebabkan oleh kandungan bioaktif yang terkandung, di antaranya adalah kandungan antioksidan, tabir surya, pelembab, dan sebagainya5. Salah satu spesies alga merah (Rhodophyta) yang banyak dibudidayakan di Indonesia adalah Eucheuma spinosum6–8. Budidaya E. spinosum di Indonesia dilakukan di berbagai daerah, seperti di perairan Lombok Timur, perairan Kabupaten Wakatobi, perairan Sumenep, dan daerah lainnya9–11. Studi literatur ini ditulis dengan tujuan untuk mengkaji potensi E. spinosum hasil budidaya Indonesia sebagai bahan produk kosmetik dan perawatan kulit yang natural dengan aktivitas senyawa yang beragam. Studi sebelumnya yang sudah pernah dilakukan adalah menguji E. spinosum sebagai bahan antioksidan8,12, bahan antibakteri13,14, hingga uji kemampuan UV filter15. Keterbatasan studi mengenai fungsi E. spinosum sebagai produk kosmetik menjadi dasar tujuan kajian literatur ini dibuat. Di dalam tulisan ini, akan dibahas mengenai kandungan senyawa yang dihasilkan E. spinosum hasil budidaya di perairan Indonesia dari berbagai studi yang sudah dilakukan, lalu dari hasil tersebut akan dilakukan analisis potensi E. spinosum sebagai produk kosmetik dan skin care.
Metode
Studi ini dilakukan dengan melakukan studi literatur berupa artikel melalui berbagai situs pencarian daring, seperti Google Scholar, MDPI, ScienceDirect, dan PubMed. Studi literatur meliputi data-data senyawa yang dihasilkan E. spinosum beserta bioaktivitasnya ditabulasikan dalam Tabel 1. Kata kunci yang digunakan untuk melakukan studi literatur ini meliputi “Eucheuma spinosum”, “Indonesia”, “kosmetik”, “bioaktivitas”, “skin care”, “metabolit sekunder”, “fitokimia”. Artikel ilmiah yang termasuk dalam Tabel 1 berupa artikel yang didapat dari hasil pencarian tanpa membatasi tahun publikasi. Untuk mendukung relevansi, kredibilitas, dan kebaruan ilmu, artikel yang dipilih akan dibatasi menjadi tahun 2014 hingga 2024. Selanjutnya, akan diambil data E. spinosum yang berasal dari perairan Indonesia untuk dibahas lebih lanjut mengenai kemampuan dan potensinya sebagai kosmetik di bagian pembahasan. Pembahasan potensi E. spinosum sebagai bahan aktif kosmetik berupa kemampuan: 1) Antioksidan; 2) Antibakteri; 3) UV Filter; 4) Anti-tyrosinase; 5) Pelembab; 6) Anti-aging. Selain itu, akan dibahas pula potensi lain E. spinosum sebagai bahan pendukung formulasi kosmetik dan bahan pengawet antibakteri.
Hasil
Data penjualan produk kosmetik dan skin care di Indonesia didapatkan dari situs web Statista.com, sehingga didapatkan tiga grafik. Grafik tersebut meliputi data pendapatan pasar kecantikan di Indonesia dari tahun 2019 hingga 2028, data nilai penjualan produk skin care di Indonesia dari tahun 2012 hingga 2016, dan data penjualan merek kosmetik di pasar online Indonesia per bulan Januari 2020. Ketiga grafik tercantum dalam Gambar 1, Gambar 2, dan Gambar 3

Gambar 1 Pendapatan pasar kecantikan dan perawatan pribadi di Indonesia dari 2019 hingga 2028 (dalam juta Dolar AS). Sumber: Statista.com
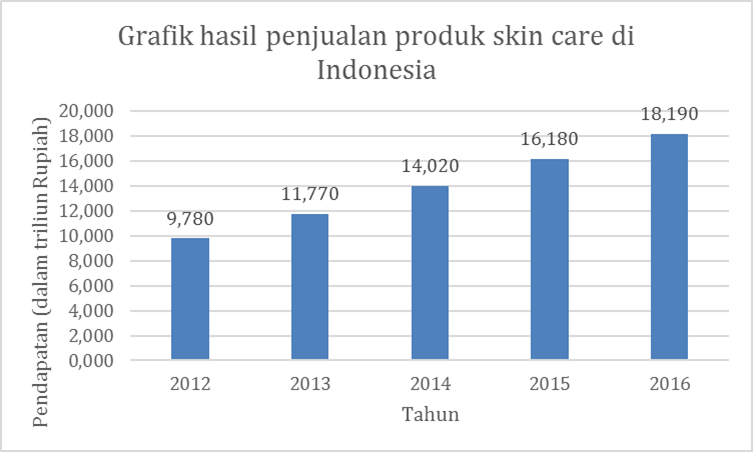
Gambar 2 Nilai penjualan produk perawatan kulit di Indonesia dari 2012 hingga 2016 (dalam triliun Rupiah). Sumber: Statista.com

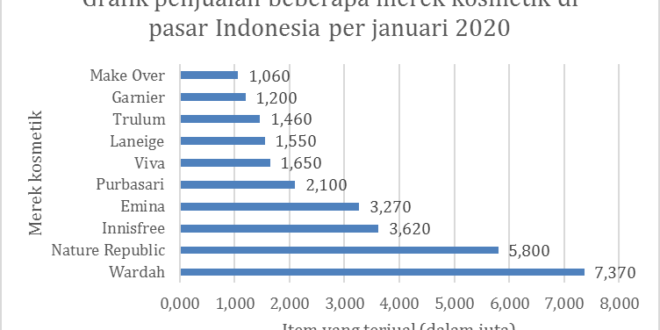
Gambar 3 Merek kosmetik terkemuka yang dijual di toko online utama di Indonesia per 7 Januari 2020, berdasarkan jumlah item yang terjual (dalam juta). Sumber: Statista.com
Hasil penelusuran mengenai kandungan senyawa dan bioaktivitas E. spinosum dari Tabel 1 dijabarkan lebih lanjut dan lebih rinci. Tabel 2 menyajikan data senyawa yang didapatkan dari ekstrak E. spinosum berdasarkan hasil uji fitokimia yang telah dilakukan di beberapa artikel. Tabel 3 menyajikan informasi mengenai kemampuan antioksidan ekstrak E. spinosum dari beberapa daerah di Indonesia. Tabel 4 menyajikan informasi mengenai kemampuan antibakteri ekstrak E. spinosum dari berbagai daerah di Indonesia.
Tabel 1 Paencarian literatur mengenai senyawa yang dihasilkan E. spinosum beserta bioaktivitasnya
| Nama Spesies | Asal Lokasi | Metode Ekstraksi | Senyawa yang Dihasilkan | Bioaktvitas | Referensi |
| Eucheuma spnosum | Nusa Penida, Bali | Microwave-Assisted Extraction | Fenol, Flavonoid, Triterpenoid | Antioksidan | [16] |
| Pulau Lemukutan, Kalimantan Barat | Maserasi | Alkaloid, steroid, flavonoid, fenol, saponin | Antioksidan | [8] | |
| N/A1 | Maserasi | N/A | Antioksidan | [17] | |
| Pulau Jang, Kepulauan Riau | Maserasi | Alkaloid, Flavonoid | Antibakteri (Vibrio alginolyticus & Aeromonas hydrophila) | [13] | |
| Binuangeun, Jawa Barat | Maserasi | Fenol | Antioksidan, Anti-Tyrosinase | [18] | |
| N/A | Maserasi | Alkaloid, Steroid, Saponin, Polifenol, Flavonoid | Antioksidan | [19] | |
| Sumenep, Jawa Timur | Sonikasi | Triterpenoid, Alkaloid, Saponin | Antioksidan | [20] | |
| Takalar, Sulawesi Selatan | Maserasi (55°C, disonikasi) | N/A | Antioksidan, Fotoprotektif | [15] | |
| Laut Flores, Nusa Tenggara Timur | Soxhlet | Alkaloid, Saponin | Antibakteri (Staphyloccocus aureus) | [21] | |
| Kudat, Sabah | Maserasi | Fenol | Antioksidan | [22] | |
| Departemen Perikanan Malaysia | Maserasi (Stirring) | N/A | Antioksidan, Antiinflamatori | [23] | |
| Takalar, Sulawesi Tenggara | Maserasi | Flavonoid, Alkaloid, Steroid, Saponin | Antibakteri (Bacillus subtilis & Escherichia coli) | [24] | |
| Wakatobi, Sulawesi Tenggara | Maserasi | N/A | Antibakteri (S. aureus & E. coli) | [25] | |
| N/A | N/A | 3-(3-methoxyphenyl) propanal | Antibakteri (S. aureus), antoksidan | [26] | |
| Labuan Aji, Nusa Tenggara Barat | Maserasi | Flavonoid, Alkaloid, Trterpenoid, Steroid, Tanin | Antioksidan | [27] | |
| Takalar, Sulawesi Selatan | Maserasi | N/A | Antibakteri (B. subtilis, E. coli) | [28] | |
| Cipatujah, Jawa Barat | Maserasi | Flavonoid, Alkaloid, Monoterpenoid & Sesquiterpenoid, Steroid | Antibakteri (Streptococcus mutans & Shigella dysenteriae) | [29] | |
| Desa Pekandangan Barat, Jawa Timur | Maserasi | N/A | Antioksidan | [30] | |
| Arakan, Sulawesi Utara | Maserasi | Fenol, Karoten | Antioksidan | [31] | |
| N/A | N/A | Alkaloid, Flavonoid, Saponin | Antibakteri (E. coli) | [14] | |
| Arakan, Sulawesi Utara | Maserasi | Steroid, Triterpenoid, Tanin | Antioksidan | [32] | |
| Kunak, Sabah | Maserasi | Fenol | Antioksidan | [33] |
1N/A menyatakan bahwa penulis tidak mencantumkan data
Tabel 2 Tabel Hasil Uji Fitokimia E. spinosum dari beberapa daerah di Indonesia
| Spesies Alga | Lokasi Budidaya | Metode Ekstraksi | Pelarut | Senyawa yang dihasilkan | Keterangan | Referensi | |||||
| Alkaloid | Flavonoid | Triterpenoid | Steroid | Tanin | Saponin | ||||||
| E. spinosum | Perairan Nusa Tenggara Barat | Heksan p.a | + | + | + | – | – | – | [34,35] | ||
| Etil Asetat p.a | + | + | + | – | – | – | |||||
| Maserasi | Kloroform p.a | – | + | + | – | – | – | Ekstrak uji berbentuk ekstrak kasar | |||
| Etanol p.a | – | + | – | + | + | + | |||||
| n-Heksan p.a | – | – | + | + | N/A | N/A | |||||
| Pulau Lemukutan, Kalimantan Barat | Maserasi | Etanol p.a | + | + | + | + | N/A | + | Ekstrak uji berbentuk ekstrak kasar | [8] | |
| Perairan Arakan, Sulawesi Utara | Metanol p.a | – | – | + | + | + | – | Ekstrak diekstrak menggunakan metanol, lalu dipartisi menggunakan n-heksan-air dan etil asetat-H2O | [32] | ||
| Maserasi | n-Heksan p.a | + | – | – | – | + | – | ||||
| Etil Asetat p.a | – | + | + | + | + | + | |||||
| Air | – | – | – | – | + | – | |||||
| Nusa Penida, Bali | MAE | Metanol 70% | N/A | + | + | – | – | N/A | Ekstrak uji berbentuk ekstrak kasar | [16] | |
| Sumenep, Jawa Timur | Sonikasi | Metanol p.a | + | – | + | – | – | – | Ekstrak uji berbentuk ekstrak kasar | [20] | |
| Diklorometana p.a | + | – | + | – | – | + | |||||
| Etil Asetat | – | – | + | – | – | + | |||||
| n-heksan | + | – | + | – | – | + | |||||
| Pulau Jang, Provinsi Riau | Maserasi | Etanol 96% | + | + | – | – | – | – | Ekstrak uji berbentuk ekstrak kasar | [13] | |
| Perairan Bangka Selatan | Maserasi | Etanol 70% | + | + | + | – | – | N/A | Ekstrak kering dipartisi menggunakan etanol-n-heksan (2:3) dan difraksinasi | [36] | |
1N/A menyatakan bahwa penulis tidak mencantumkan data
Tabel 3 Kemampuan antioksidan E. spinosum dari perairan Indonesia berdasarkan nilai IC50
| Spesies | Lokasi Asal | Metode Ekstraksi | Pelarut | Nilai IC50 Metode DPPH | Referensi |
| Eucheuma spinosum | Pulau Lemukutan, Kalimantan Barat | Maserasi | Etanol p.a | 90,100 ppm | [8] |
| Nusa penida, Bali | MAE | Metanol p.a | 36,300 ± 9,200 ppm | [16] | |
| Sumenep, Jawa Timur | Sonikasi | Etil asetat p.a | 384,860 ppm | [20] | |
| Labuan Aji, Nusa Tenggara Barat | Maserasi | Etil asetat p.a | 430,500 ppm | [27] | |
| Takalar, Sulawesi Selatan | Sonikasi | n-heksan | 2816,680 ppm | [15] |
Tabel 4 Uji kemampuan antibakteri E. spinosum budidaya Indonesia terhadap beberapa spesies bakteri
| Spesies | Lokasi Asal | Metode Ekstraksi | Pelarut | Metode Uji Antibakteri | Bakteri Uji | Zona Hambat (terkecil; terbesar) | Klasifikasi Kekuatan Inhibisi | Referensi |
| Eucheuma spinosum | Laut Flores, Nusa Tenggara Timur | Soxhlet | Etanol 96% | Difusi Cakram | S. aureus (gram +) | 6 mm (konsentrasi 1%); 16,300 mm (konsetrasi 15%) | Kurang efektif pada konentrasi 1%, Sedang pada konsentrasi 15% | [21] |
| Pulau Jang, Kepulauan Riau | Maserasi | Etanol 96% | Difusi Cakram | Vibrio alginolyticus (gram -) | 10,870±7,080 mm (k. 12,5%); 21,030±8,000 mm (k. 50%) | Lemah pada konsentrasi 12,5%, Kuat pada konsentrasi 50% | [13] | |
| Aeromonas hydrophila (gram -) | 15,900±1,840 mm (k. 12,5%); 25,330±1,000 mm (k. 50%) | Lemah pada konsentrasi 12,5%, kuat pada konsentrasi 50% | ||||||
| Cipatujah, Jawa Barat | Maserasi | Etil asetat p.a | Difusi Cakram | S. mutans (gram +) | 7,100±0,140 mm (k. 0,002%); 9,150±0,210 mm (k. 0,006%) | Kurang efektif pada konsentrasi 0,002%, Kurang efektif pada konsentrasi 0,002% | [29] | |
| Shigella dysenteriae (gram -) | 7,780±0,110 mm (k. 0,002% ppm); 7,850±0,140 mm (k. 0,006%) | Kurang efektif pada konsentrasi 0,002%, kurang efektif pada konsentrasi 0,006% | ||||||
| N/A | Maserasi | Etanol p.a | Difusi Sumuran | E. coli (gram -) | 16 mm (k. 60%); 30 mm (k. 90%) | Sedang pada konsentrasi 60%, kuat pada kosentrasi 90% | [14] |
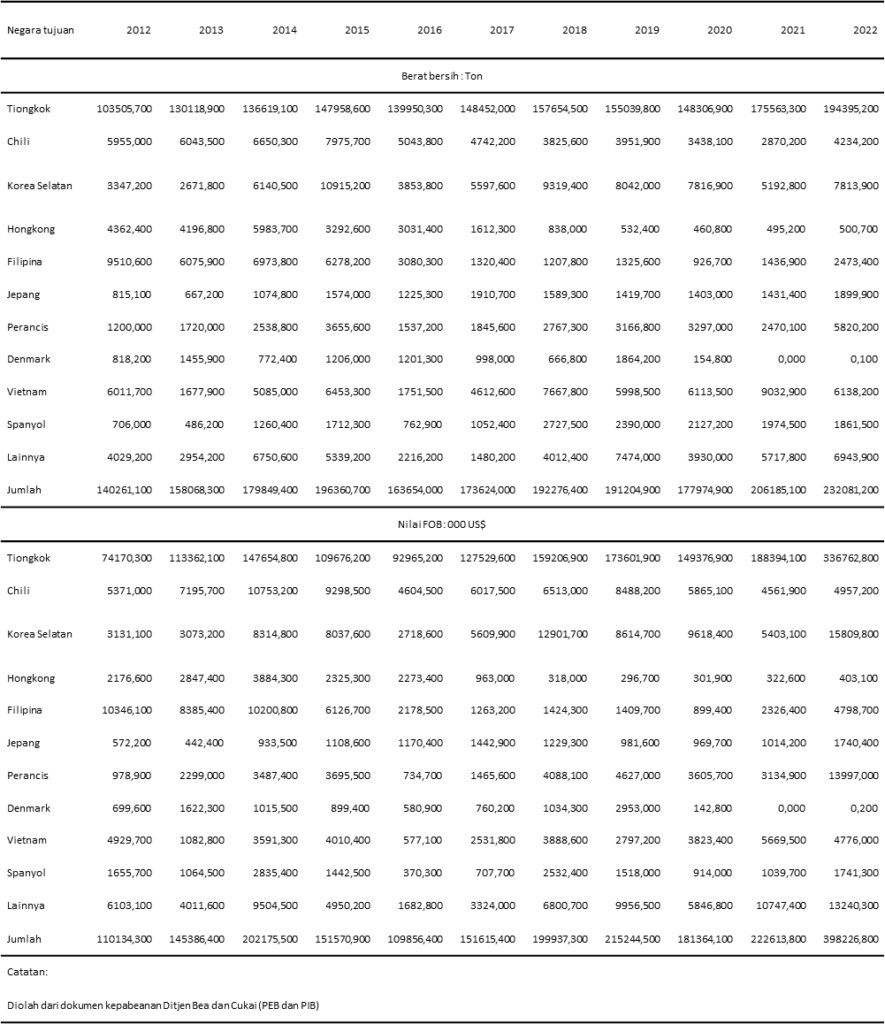
Dilakukan penelusuran mengenai penjualan ekspor rumput laut dan ganggang Indonesia untuk mengetahui berapa banyak permintaan rumput laut hasil budidaya perairan Indonesia oleh negara lain di seluruh dunia. Data penjualan tersebut tercantum dalam Tabel 5.
Tabel 5 Data volume dan pendapatan ekspor rumput laut dan ganggang lain Indonesia (Sumber: Badan Pusat Statistik Indonesia)
Dilakukan pula perbandingan kandungan senyawa dengan aktivitas antioksidan, seperti flavonoid, fenol, dan karotenoid pada E. spinosum dengan alga lain. Data perbandingan ini tercantum pada Tabel 6. Sementara itu, Tabel 7 memuat data perbandingan nilai aktivitas antioksidan yang dihasilkan E. spinosum dengan spesies alga lain.
Tabel 6 Perbandingan Kandungan Total Flavonoid, Total Fenolik, dan Total Karotenoid pada beberapa jenis alga
| Flavonoid | ||||
| Nama Spesies | Kelompok | Lokasi Asal | Total flavonoid | Referensi |
| Eucheuma spinosum | Alga merah | Nusa Penida, Provinsi Bali (Tropis) | 789,210±17,250 mg QE/g | [88] |
| Eucheuma cottonii | Pantai Lontar, Serang, Banten | 35,180 mg QE/g | [89] | |
| Nusa Penida, Provinsi Bali (Tropis) | 109,440 ± 15,030 mg QE/g | [16] | ||
| Cystoseira amentacea | Alga cokelat | Teluk Iskenderun, Turki (Mediterranean) | 1,820 ± 0,750 mg QE/g | [90] |
| Laut Ligurian, Mediterrania Barat Laut (Sub-tropis) | 15,80 ± 0,510 mg QE/g | [91] | ||
| Cladophora glomerata | Alga hijau | Danau Oporzynskie, Polandia (Sub-Tropis) | 1,770 ± 0,100 mg QE/g | [92] |
| Danau Oporzynskie, Polandia (Sub-Tropis) | 1,460 ± 0,080 mg QE/g | [93] | ||
| Fenol | ||||
| Nama Spesies | Kelompok | Total Fenol | Referensi | |
| Eucheuma spinosum | Alga merah | Nusa Penida, Provinsi Bali (Tropis) | 62,980 ± 6,400 mg GAE/g | [16] |
| Pulau Lemukutan, Kalimantan Barat | 16,470 ± 0,140 mg GAE/g | [8] | ||
| Eucheuma cottonii | Pantai Lontar, Serang, Banten | 141 mg GAE/g | [89] | |
| Laminaria digitata | Alga cokelat | Pesisir Barat Irlandia (Sub-tropis) | 0,005 ± 0,000 mg GAE/mg | [94] |
| Breiðafjörður, Islandia Barat (Sub-tropis) | 4,400 ± 0,100 mg GAE/ g | [95] | ||
| Codium fragile | Alga hijau | Pesisir Barat Irlandia (Sub-topis) | 0,008 ± 0,000 mg GAE/mg | [94] |
| Güzelyalı-Karanlık Liman, Turki (Sub-Tropis) | 0,064±0,000 mg GAE/mg | [96] | ||
| Karotenoid | ||||
| Nama Spesies | Kelompok | Total Karotenoid | Referensi | |
| Eucheuma spinosum | Alga merah | Perairan Arakan, Sulawesi Utara | 0,008 ± 0,000 mg/g | [31] |
| Eucheuma cottonii | Pamekasan, Madura | 0,210 mg/g | [97] | |
| Cladophora glomerata | Alga hijau | Greater Poland, Polandia (Sub-tropis) | 0,003 ± 0,000 mg/ml | [98] |
| Sungai Lithuania (Sub-Tropis) | 0.23 mg/L | [99] | ||
| Ulva flexuosa | Alga hijau | Greater Poland, Polandia (Sub-tropis) | 0,002 ± 0,000 mg/ml | [98] |
| Teluk Persia, Iran (Sub-Tropis) | 0.020±0.020 mg/g | [100] | ||
| Sirophysalis trinodis | Alga cokelat | Teluk Persia (Sub-Tropis) | 0,002± 0.000 mg/g | [101] |
| Kota Hurghada, Laut Merah, Mesir (Sub-Tropis) | 0,027± 0,001 mg/g | [102] | ||
| Polycladia myrica | Alga cokelat | Teluk Persia (Sub-Tropis) | 0,001 ± 0.000 mg/g | [101] |
| Kota Hurghada, Laut Merah, Mesir (Sub-Tropis) | 0,024 ± 0,000mg/g | [102] | ||
Tabel 7 Perbandingan aktivitas antioksidan E. spinosum dengan spesies alga lainnya
| Antioksidan | ||||||||
| Nama Spesies | Kelompok | Lokasi asal | Metode Ekstraksi | Pelarut | Nilai IC50 Metode DPPH | Referensi | ||
| Euheuma spinosum | Alga merah | Nusa penida, Bali Pulau Lemukutan, Kalimantan Barat | MAE | Metanol p.a | 36,300 ± 9,200 μg/ml | [16] | ||
| Maserasi | Etanol p.a | 90,100 μg/ml | [8] | |||||
| Eucheuma cottonii | Alga merah | Pesisir Semporna, Sabah | Maserasi (Waterbath 70°C) | Air destilasi | 1,990 μg/ml | [117] | ||
| Pulau Lemukutan, Kalimantan Barat | Maserasi | Etanol 70% | 127,750 μg/ml | [118] | ||||
| Gracilaria sp | Alga merah | Perairan Bintan, Kepulauan Riau | Maserasi | Metanol p.a | 982,250 μg/ml | [119] | ||
| Pulau Serangan, Bali | Maserasi | Etanol 100% | 13,603 ± 0,413 µg/ml | [120] | ||||
| Halymeda gracilis | Alga Hijau | Pulau Karya, kepulauan Seribu | Maserasi | Metanol p.a | 290,490 μg/ml | [121] | ||
| Valoniopsis pachynema | Alga hijau | Pesisir Mandapam, India Selatan | Maserasi | Metanol p.a | 98 μg/ml | [122] | ||
| 73,390 ± 0,030 μg/ml | [123] | |||||||
| Chlorococcum humicola | Alga hijau | Pesisir Rameshwaram, Tamil Nadu | 96,52 μg/ml | [124] | ||||
| Ekstraksi Soxhlet | Etanol p.a | 94 ± 1,800 μg/ml | [125] | |||||
| Padina gymnospora | Alga Coklat | Teluk Persia | Maserasi | Metanol 80% | 746,760 ± 94,150 μg/ml | [126] | ||
| Pekan, Malaysia | Maserasi | Air destilasi | 2,565 ± 0,020 μg/ml | [127] | ||||
| Padina australis | Alga Coklat | Takalar, Sulawesi Selatan | Sonikasi | Metanol p.a | 102,590 µg/mL | [128] | ||
| Pulau Dutungan, Sulawesi selatan | Maserasi | Etil asetat p.a | 259,480 μg/ml | [129] | ||||
| Sargassum sp. | Alga coklat | Manado, Sulawesi Utara | Maserasi | Etanol p.a | 2,684±0,256 μg/ml | [130] | ||
Pembahasan
Penggunaan Kosmetik Masyarakat Indonesia
Pentingnya menjaga penampilan menjadi alasan konsumen untuk membeli produk-produk kosmetik. Di Indonesia sendiri, tidak menutup kemungkinan bahwa industri kecantikan akan menjadi salah satu penggerak ekonomi paling utama karena Indonesia merupakan Negara dengan populasi terbanyak ke-4 di dunia. Selain itu, potensi dan kekayaan alam di Indonesia juga mendukung perusahaan kosmetik luar dan dalam negeri untuk mengembangkan produk kosmetik dan skin care natural yang berkualitas. Beberapa studi menunjukkan faktor yang mempengaruhi konsumen untuk membeli suatu produk kosmetik dan skin care adalah pemasaran pada media sosial yang ekstensif37,38. Sebuah laporan data yang diambil dari Statista, berupa data pendapatan produk kecantikan di Indonesia sejak tahun 2019 dan prakiraan pendapatan hingga tahun 2028, tercantum pada Gambar 1. Dari tahun 2019 ke 2020, penjualan berkurang kemungkinan karena adanya pandemi COVID-19. Sejak tahun 2020, penjualan terus meningkat sehingga prediksi hingga tahun 2028 akan terus meningkat. Adapun untuk produk skin care sendiri, data penjualan tercantum pada Gambar 2 dan menunjukkan bahwa penjualan tetap meningkat dari tahun 2012 higga 2016. Peningkatan penjualan tersebut kemungkinan karena sifat konsumen produk kosmetik Indonesia yang impulsif dan kecenderungan terhadap promosi, sehingga konsumen seringkali membeli produk kosmetik melebihi jumlah produk yang mereka butuhkan39.
Bertahannya nilai penjualan kosmetik dari tahun ke tahun diakibatkan oleh reputasi dan citra merek yang tidak asing di kalangan masyarakat Indonesia. Salah satu tolak ukur kesuksesan suatu perusahaan dalam membangun merek adalah ekuitas merek yang merupakan kekuatan suatu produk untuk dikenal oleh konsumen dari segi kualitas, persaingan, harga pasar, dan profibilitas perusahaan, sehingga dapat membangun kepercayaan konsumen terhadap merek tersebut40,41. Dengan memperhatikan citra merek, kualitas, dan harga, suatu produk dapat meningkatkan kepercayaan dan loyalitas konsumen. Berdasarkan studi pada merek kosmetik lokal Wardah, kualitas produk dan citra merek mempengaruhi loyalitas konsumen, namun tidak begitu signifikan jika dibandingkan dengan harga produk42–44. Pada studi yang sejenis, loyalitas konsumen terhadap suatu produk kosmetik di Indonesia tidak dipengaruhi oleh persepsi kualitas suatu produk41,45, yang berarti kualitas produk dari sebuah merek tidak selamanya bisa mempertahankan konsumen karena bisa saja muncul produk lain yang lebih berkualitas.
Merek kosmetik dan produk kecantikan lokal sudah diakui kualitasnya dan dapat dipercaya oleh masyarakat Indonesia, sebagaimana ditunjukkan pada Gambar 3. Dari grafik tersebut, penjualan kosmetik di Indonesia masih diungguli oleh merek lokal, yaitu Wardah yang berdiri dibawah PT. Paragon Technology and Innovation. Namun, urutan tertinggi kedua diduduki oleh merek Nature Republic dari Korea Selatan. Disusul oleh merek Innisfree di urutan ketiga, yang berdiri di bawah Amorepacific, sebuah perusahaan asal Korea Selatan. Dari fakta ini, timbul permasalahan bahwa produk kosmetik lokal harus membangun citra merek yang baik terhadap konsumen agar mampu menyaingi produk kosmetik internasional. Kualitas kosmetik tidak begitu berpengaruh terhadap loyalitas konsumen di Indonesia41–45, sehingga jika merek lokal mampu memproduksi kosmetik yang sama kualitasnya dengan produk internasional, konsumen tidak akan ragu untuk beralih kepada produk lokal. Terlebih lagi, produk kosmetik lokal biasanya jauh lebih terjagkau dari segi harga dan mampu memenuhi kebutuhan standar kulit konsumen Indonesia46.
Bahan Alam Sebagai Bahan Aktif Kosmetik
Maraknya penggunaan produk kosmetik dan skin care di kalngan masyarakat Indonesia menimbulkan masalah baru bagi kesehatan lingkungan. Bahan-bahan aktif yang umum digunakan pada produk kosmetik seperti paraben, triclosan, dan siloxane jika dikonsumsi dalam jangka panjang akan mengakibatkan efek toksik pada kesehatan kulit, juga menimbulkan masalah ekologis pada ekosistem akuatik dan terestrial dikarenakan bahan-bahan tersebut dibuang dalam jumlah yang besar47,48. Penggunaan bahan alam sebagai bahan aktif pada produk kosmetik bisa menjadi solusi utama permasalahan tersebut. Dengan adanya kesadaran terhadap kesehatan diri dan kesehatan lingkungan, konsumen mampu mempertimbangkan untuk memilih produk natural dan menuntut perusahaan kosmetik untuk mengembangkan produk yang menggunakan bahan-bahan natural47,49.
Green marketing menjadi salah satu upaya perusahaan kosmetik sebagai strategi pemasaran dalam rangka mendukung produk yang lebih ramah lingkungan50–52. Pada konsepnya, green marketing memberikan alternatif produk kepada konsumen untuk mulai mengonsumsi produk yang ramah lingkungan, sehingga akan tercipta citra merek yang positif dan dan menguatkan persepsi positif konsumen terhadap merek tersebut50,53,54. Menurut beberapa studi yang sudah dilakukan di Indonesia, pertimbangan konsumen untuk membeli produk yang ramah lingkungan berhubungan positif dengan kepedulian konsumen terhadap lingkungan51,52,55,56. Hal ini tidak menutup kemungkinan bahwa pengetahuan dan kepedulian konsumen Indonesia dalam menjaga lingkungan akan membuat konsumen beralih menggunakan produk yang lebih ramah lingkungan. Namun, Kurnia & Mayangsari (2020) melakukan studi mengenai keterbatasan konsumen Indonesia dalam menggunakan produk yang ramah lingkungan57. Di antaranya adalah harga produk yang jauh lebih mahal, produk baru yang kalah bersaing dengan produk sejenis yang sudah tersedia di pasaran, resiko produk baru yang belum dapat sertifikasi, penggunaan produk produk konvensional yang sudah menjadi tradisi, dan citra produk baru yang belum dipercaya konsumen. Untuk mengatasi keterbatasan tersebut, perusahaan bisa melakukan riset lebih lanjut mengenai strategi pemasaran di Indonesia dan mengembangkan inovasi baru terhadap produk yang akan dikembangkan.
Contoh bahan alam yang dapat digunakan secara berkelanjutan adalah mineral, air, ekstrak tumbuhan, mikroalga, dan rumput laut58,59. Beberapa bahan alam yang sudah banyak digunakan sebagai bahan aktif produk kosmetik dan skin care Indonesia meliputi lidah buaya (Aloe barbadensis), bakuchiol dari tanaman babchi (Psoralea corylifolia), buah lemon (Citrus limon), mentimun (Cucumis sativus), bengkuang (Pachyrhizus erosus), teh hijau (Camellia sinensis), hingga spirulina (golongan cyanobacteria). Bahan alam sudah banyak digunakan sebagai kosmetik sejak berabad-abad yang lalu, sehingga tidak perlu diragukan khasiatnya untuk dipakai secara turun-temurun59,60. Keuntungan terbesar dari penggunaan bahan alam pada kosmetik adalah sifatnya yang lembut di kulit namun tetap efektif, lebih aman, tidak berbahaya bagi kulit, dan tidak ada efek samping61(61).
Perlu diketahui bahwa penggunaan bahan alam memiliki tantangannya tersendiri. Dari tiap studi mengenai kandungan senyawa pada bahan alam, terdapat perbedaan senyawa yang dikandungnya. Misalnya, kandungan senyawa fenolik yang dihasilkan suatu bahan alam bisa berbeda berdasarkan metode ekstraksi, temperatur ekstraksi, ukuran partikel, dan tipe pelarut yang digunakan62,63(62,63). Selain itu, kandungan senyawa fenol pada suatu bahan alam juga bisa berbeda berdasarkan kondisi geografisnya sebagai mekanisme pertahanan bahan alam terhadap lingkungannya. Contohnya, tumbuhan memproduksi flavonoid untuk mempertahankan diri dari paparan sinar UV matahari, dan setiap daerah memiliki indeks UV yang berbeda sehingga kandungan senyawa flavonoid pun bisa berbeda62,63. Perbedaan ini bisa jadi pertimbangan untuk produsen kosmetik dan skin care untuk menentukan daerah pemasok bahan alam dan metode ekstraksi yang digunakan.
Bahan aktif kosmetik pada rumput laut
Senyawa alami digunakan sebagai bahan kosmetik memiliki keuntungan yang lebih banyak dibanding komposisi yang ada pada produk kosmetik pada umumnya, karena biasanya lebih ramah lingkungan, tidak beracun, tidak bersifat karsinogenik, lebih mudah didapatkan, dan lebih menguntungkan perekonomian64. Alga merah dapat menghasilkan senyawa yang berpotensial menjadi kosmetik, seperti polisakarida, protein, senyawa fenol dan terpenoid, dan pigmen. MAA (Mycosporine-like Amino Acids) merupakan senyawa asam amino yang banyak dihasilkan rumput laut Rhodophyceae memiliki kemampuan melindungi kulit dari kerusakan yang diakibatkan sinar UV, anti penuaan dini, antioksidan, dan anti hipersensitif65–67. Alga merah menghasilkan banyak senyawa pigmen, seperti karotenoid, klorofil (a, b, dan c), fikobilin, dan fikoeritrin64,68. Karotenoid banyak digunakan dalam kosmetik sebagai senyawa antioksidan, contohnya β-Carotene dan fucoxanthin5,69.
Beberapa rumput laut hasil budidaya dari perairan Indonesia juga sudah diuji kemampuannya sebagai bahan aktif pada kosmetik. Maharany et al. (2017) meneliti kemampuan antioksidan rumput laut Padina australis dengan Eucheuma cottonii sebagai sediaan krim tabir surya, dan dihasilkan senyawa antioksidan yang aktif70. Rumput laut dari perairan Indonesia sudah banyak diuji kandungan antioksidannya, seperti Eucheuma cottonii71–73 dan Sargassum sp.73–76, sehingga rumput laut jenis ini sangat berpotensi sebagai bahan aktif kosmetik. Kombinasi Sargassum sp. dan Eucheuma cottonii dengan ampas teh sebagai masker wajah anti jerawat menunjukkan adanya aktivitas antibakteri terhadap bakteri Propionibacterium acnes dan Staphylococcus aureus73. Rumput laut lain yang juga memiliki aktivitas antibakteri positif terhadap bakteri P. acnes meliputi Gracilaria verrucosa dan Kappapychus alvarezii77,78.
Penjelasan umum Eucheuma spinosum dan status ekspornya di Indonesia
Eucheuma spinosum merupakan rumput laut dari divisi Rhodophyta atau kelompok alga merah. E. spinosum memiliki ciri morfologi thallus yang berbentuk silindris, dengan percabangan thallusnya memiliki ujung yang cenderung meruncing, dan pada tiap cabangnya terdapat tonjolan lunak yang disebut nodulus, dimana tonjolan-tonjolan tersebut mengitari cabangnya79,80. Warna yang tampak pada E. spinosum adalah coklat gelap, coklat terang, hingga kehijauan81. E. spinosum dapat tumbuh di kondisi perairan dengan suhu optimal di antara 26-30˚C, kedalaman perairan berkisar di 10-50 meter dengan kecepatan arus optimal di 0,1-0,4 m/detik82,83. Dengan kondisi perairan optimal seperti yang telah disebutkan, E. spinosum dapat tumbuh di hampir seluruh perairan di Indonesia.

Gambar 4 Rumput laut Eucheuma spinosum yang dibudidayakan di Ketapang, Lampung Selatan
Berdasarkan data pada Tabel 5, ekspor rumput laut Indonesia paling banyak ke Tiongkok hingga mencapai 194.395 ton pada tahun 2022. Banyaknya volume ekspor rumput laut Indonesia menjadi bukti bahwa kualitas rumput laut Indonesia sangat diminati oleh banyak negara. Berdasarkan data yang diambil dari web indonesianimporter.com di tanggal 18 Maret 2020, jumlah ekspor E. spinosum kering ke negara Perancis sendiri mencapai 60.000 kg dengan FOB sebesar 30.000 USD.
Senyawa yang dihasilkan E. spinosum dan potensinya sebagai produk kosmetik
Hasil Uji Fitokimia E. spinosum Menurut Beberapa Studi di Indonesia
Data pada Tabel 2 menunjukkan hasil uji fitokimia E. spinosum yang didapat dari perairan Indonesia. Dari data tersebut, diperoleh hasil metabolit sekunder yang paling umum ditemukan adalah senyawa triterpenoid, disusul dengan alkaloid dan flavonoid dengan frekuensi hasil positif yang sama. Hampir semua jenis pelarut mampu mengekstrak senyawa triterpenoid dari E. spinosum, kecuali pelarut air dan etanol konsentrasi tinggi. Hal ini disebabkan oleh sifat senyawa triterpenoid umumnya bersifat non-polar atau semi-polar, sehingga pelarut polar seperti air dan etanol tidak mampu mengekstraksi triterpenoid secara maksimal. Saat ini, pengetahuan mengenai jenis senyawa triterpenoid yang terkandung dalam E. spinosum masih sangat terbatas, sehingga tidak bisa disimpulkan bagaimana sifat fisika dan kimia triterpenoid dalam E. spnosum dalam melakukan ekstraksi. Adapun beberapa senyawa triterpenoid yang mampu diisolasi dari jenis alga lain adalah asam dwarkenoic dari alga hijau Codium dwarkenese yang merupakan turunan dari asam ursolic84 dan triterpene-squalene dari alga coklat Padina boergesenii85. Kedua senyawa tersebut merupakan turunan dari senyawa squalene yang memiliki polaritas rendah, sehingga kelarutannya dalam air sangat rendah. Belum ada temuan lebih lanjut mengenai bioaktivitas senyawa asam dwarkenoic, namun dari riset yang dilakukan Ali et al. (2015), asam dwarkenoic mampu menunjukkan aktivitas anti-diabetik. Sementara itu, squalene sudah diketahui memiliki berbagai bioaktivitas yang penting sebagai produk kosmetik dan skin care, seperti anti-inflamasi, detoksifikasi, dan antioksidan86. Dari studi yang dilakukan Tran et al. (2021) terhadap alga merah asal Vietnam Tricleocarpa fragilis, ditemukan senyawa triterpenoid baru: methyl-3b,25-dihydroxycycloart-23-en-29-oate 3-sulfate; methyl 3b-hydroxy, 25- methoxycycloart-23-en-29-oate 3-sulfate; 3b-hydroxy, 25-methoxycycloart-23-en-3-sulfate; dan 3b-hydroxycycloart-24-en-23-one 3-sulfate87.
Senyawa flavonoid pada E. spinosum dapat diekstrak menggunakan pelarut etanol, baik dalam konsentrasi tinggi maupun lebih rendah. Sementara itu, pelarut metanol tidak dapat mengekstrak flavonoid secara maksimal. Namun, pada studi yang dilakukan Rismayanti & Husni (2021), ekstrak metanolik E. spinosum diekstrak menggunakan metode Microwave Assisted Extraction (MAE) selama 10 menit dan didapatkan flavonoid total sebesar 109 44 ± 15.03 mg QE (Quercetin Equivalent)/g16. Hal ini membuktikan bahwa perbedaan metode ekstraksi bisa mempengaruhi hasil ekstrak yang berbeda. Untuk mengekstrak alkaloid, pelarut etanol merupakan pelarut yang terbaik meski studi milik Subroto et al. (2019) mendapatkan hasil negatif alkaloid pada ekstrak etanolik E. spinosum34. Hasil positif senyawa steroid pada E. spinosum ditemukan tidak konsisten terhadap semua pelarut, mengindikasikan bahwa keberhasilan untuk mengekstrak senyawa steroid ditentukan oleh kondisi geografis sampel. Kasus ini sama dengan senyawa tannin dan saponin.
Potensi E. spinosum sebagai antioksidan
Senyawa antioksidan merupakan senyawa, yang dalam dosis rendah dapat menghambat atau mencegah oksidasi suatu substrat103(103). Antioksidan sebagi penyerap radikal bebas penting untuk melindungi sel dari stres oksidatif dan menjaga keseimbangan spesies oksigen beracun104. Aktivitas antioksidan pada suatu senyawa ditetapkan dengan IC50, konsentrasi yang dibutuhkan untuk mengurangi 50% radikal bebas105, dimana semakin rendah IC50 suatu senyawa maka semakin kuat aktivitas antioksidannya. Adapun klasifikasi kekuatan aktivitas antioksidan, senyawa dengaan IC50 kurang dari 50 ppm dikelompokkan sebagai antioksidan sangat kuat, 50-100 ppm dikelompokkan sebagai antioksidan kuat, dan 100-150 ppm dikelompokkan sebagai antioksidan lemah106.
Tabel 3 memuat data kemampuan antioksidan E. spinosum berdasarkan IC50 menggunakan metode 1,1-diphenyl-2- picrylhydrazyl (DPPH). Dari Tabel 3, kemampuan antioksidan E. spinosum hasil budidaya perairan Indonesia sangat variatif. Sebagian besar E. spinosum dari Indonesia memiliki aktivitas antioksidan yang tergolong lemah. Sementara itu, aktivitas antioksidan yang kuat ditemukan dalam studi milik Sofiana et al. (2020) yang menggunakan E. spinosum dari Pulau Lemukutan Kalimantan Barat8. Aktivtias antioksidan yang sangat kuat didapatkan oleh Rismayanti & Husni (2021) yang menggunakan E. psinosum dari Nusa Penida, Bali, dan menggunakan metode ekstraksi yang lebih modern, yaitu metode Microwave Assisted Extraction (MAE)16.
Dari studi-studi tersebut, dapat dinyatakan bahwa aktivitas antioksidan disebabkan karena adanya kandungan fenol pada ekstrak, meliputi tanin, flavonoid, triterpenoid dan steroid. Kelompok tanin dengan berat molekul yang relatif tinggi menunjukkan aktivitas antioksidan yang lebih besar dibandingkan fenol sederhana107. Gugus hidroksil fenol diketahui mempunyai peranan besar dalam aktivitas antioksidan, khususnya flavonoid108–110. Kombinasi senyawa fenolik dan saponin (ekstrak kasar) mempunyai aktivitas antioksidan lebih tinggi dibandingkan saponin yang diisolasi dari sumber yang sama. Hal ini menunjukkan bahwa molekul lain meningkatkan aktivitas antioksidan ekstrak111. Senyawa steroid menunjukkan aktivitas pembilasan tertinggi pada pembentukan ROS intraseluler112. Kandungan triterpenoid pada studi milik Herbeoui et al. (2018) memiliki aktivitas antioksidan113.
Flavonoid sebagai salah satu senyawa antioksidan, merupakan senyawa fenolik yang dicirikan oleh oksigen heterosiklik yang terikat pada dua cincin aromatik, yang tingkat hidrogenasinya bervariasi114,115. Flavonoid sudah diakui kemampuannya sebagai antioksidan yang dapat menangkap radikal bebas. Dalam industri kosmetik, flavonoid digunakan sebagai bahan fotoprotektif, anti-aging, dan antiinflamasi116. Studi mengenai kandungan flavonoid pada E. spinosum sudah banyak dilakukan. Sofiana et al. (2020) menguji kandungan flavonoid secara kualitatif pada ekstrak etanolik E. spinosum, dan ditemukan kandungan flavonoid yang cukup melimpah8. Pada studi yang dilakukan Podungge et al. (2018) juga dilakukan uji kualitatif kandungan flavonoid pada ekstrak etanolik dan metanolik E. spinosum, dan dihasilkan bahwa flavonoid terkandung pada kedua ekstrak, dengan nilai IC50 aktivitas antioksidan tertinggi pada ekstrak etanol 95%, sebesar 97,52219. Uji total flavonoid pada ekstrak metanolik E. spinosum dilakukan oleh Rismayanti & Husni (2021), dimana total flavonoid yang dihasilkan E. spinosum sebanyak 109 44 ± 15.03 mg QE/g16. Perbandingan total flavonoid yang dihasilkan E. spinosum dengan alga lain bisa dilihat pada Tabel 6.
E. spinosum hasil budidaya perairan Indonesia cukup berpotensi untuk dijadikan sumber antioksidan pada produk pangan, farmasi, hingga kosmeseutika. Namun, karena kemampuan antioksidannya yang fluktuatif berdasarkan data-data yang telah dikumpulkan, perlu pertimbangan lebih lanjut untuk mengembangkan potensi antioksidan E. spinosum. Misalnya, kualitas perairan lokasi budidaya E. spinosum harus yang sesuai dengan parameter optimal untuk pertumbuhan E. spinosum dan terhindar dari zat pencemar, hama, atau predator yang menyerang E. spinosum. Hal lain yang perlu dipertimbangkan meliputi pemilihan metode ekstraksi yang lebih efisien yang mampu menyerap lebih banyak ekstrak dan senyawa bioaktif. Adapun jenis rumput laut hasil budidaya perairan Indonesia lainnya yang umumnya memiliki potensi sebagai kosmetik meliputi Eucheuma cottonii71–73, Sargassum sp.73–76, dan Caulerpa sp.131,132, sebagai bahan antioksidan. E. spinosum hasil budidaya perairan Indonesia mampu bersaing dengan jenis-jenis rumput laut tersebut dan bisa dilakukan riset lanjutan mengenai potensi antioksidan yang terkandung.
Pada Tabel 7, diambil data E. spinosum yang memiliki aktivitas antioksidan tertinggi dari Tabel 3. Jika dibandingkan dengan spesies satu genusnya, E. cottonii, aktivitas antioksidan E. spinosum lebih tinggi, karena ditemukan aktivitas antioksidan tertinggi pada E. cottonii dengan nilai IC50 sebesar 127,75 μg/ml. Berbeda kasusnya dengan spesies alga merah lain, Gracilaria sp., ditemukan memiliki aktivitas antioksidan tertinggi dengan nilai IC50 sebesar 13,603 ± 0,413 µg/ml yang menjadikan E. spinosum memliki aktivitas antioksidan yang jauh lebih lemah. Adapun spesies alga hijau yang memiliki kemampuan aktivitas antioksidan yang setara dengan E. spinosum, yaitu Valoniopsis pachynema dan Chlorococcum humicola yang diambil dari Pesisir Tamil Nadu, India Selatan. Sementara itu, jika dibandingkan dengan spesies lain yang terdapat pada Tabel 7, E. spinosum memiliki aktivitas antioksidan yang lebih tinggi dari beberapa spesies alga lain. Hal ini mampu membuktikan bahwa E. spinosum yang dihasilkan di perairan Indonesia mampu bersaing dengan jenis alga lainnya sebagai penghasil senyawa antioksidan.
Potensi E. spinosum sebagai antibakteri
Dalam industri kosmetik, penggunaan senyawa antibakteri sebagai bahan aktif dalam produk kosmetik memiliki tujuan untuk mencegah kulit dari infeksi bakteri yang menyerang kulit, seperti Cutibacterium acnes (sebelumnya diketahui sebagai Propionibacterium acnes) yang merupakan bakteri penyebab inflamasi jerawat133. Bakteri lain dalam mikrobioma kulit manusia yang juga berperan dalam pembentukan jerawat adalah Staphylococcus epidermidis dan Staphylococcus aureus134. Beberapa data uji antibakteri E. spinosum yang telah dilakukan dimuat dalam Tabel 4. Pada studi yang dilakukan Safitri et al. (2018), ekstrak etanolik E. spinosum menghasilkan kemampuan antibakteri terhadap bakteri S. aureus yang paling optimal pada konsentrasi ekstrak 15% dengan diameter zona hambat sebesar 16,3 mm21. Perhitungan minimum inhibitory concentration (MIC) dilakukan untuk melihat adanya pertumbuhan bakteri pada ekstrak selama 24 jam, dan dihasilkan unit pembentukan koloni (CFU) bakteri sebanyak 0 dan tingkat kekeruhan bakteri sangat jernih pada konsentrasi ekstrak 15%.
Senyawa antibakteri juga sering digunakan dalam produksi kosmetik sebagai bahan pengawet produk agar terhindar dari kontaminasi bakteri. Produk kosmetik seringkali mengandung air dan nutrien yang mampu mendukung mikroorganisme untuk tumbuh di dalam produk135, sehingga menyebabkan kualitas produk menurun dan menimbulkan masalah kulit yang lebih serius. Adapun bahan pengawet yang biasa digunakan dalam industri kosmetik meliputi methylisothiazolinone, iodopropynyl butylcarbamate, ethylhexylglycerin, methylparaben, dan phenoxyethanol136. Namun, beberapa bahan memiliki dampak yang buruk terhadap kesehatan, seperti paraben yang mengganggu hormon reproduktif manusia dengan aktivitas estrogeniknya137. Sesuai regulasi dari Direksi Kosmetik Eropa dan FDA, konsentrasi maksimum paraben dalam kosmetik adalah 0,4% sebagai ester Tunggal, dan 0,8% sebagai ester campuran138. Penggunaan bahan pengawet yang lebih aman, seperti bahan natural, menjadi solusi untuk pengawetan produk kosmetik. Data uji antibakteri E. spinosum terhadap bakteri kontaminan tercantum dalam Tabel 4. Perbedaan hasil uji pada beberapa studi disebabkan karena jenis bakteri uji, metode ekstraksi sampel, dan lokasi sampel didapatkan. Pada Tabel 4, dapat disimpulkan bahwa ekstrak E. spinosum memiliki aktivitas antibakteri yang lebih kuat terhadap bakteri gram positif. Hal ini ditunjukkan pada konsentrasi 15%, ekstrak E. spinosum memiliki aktivitas antibakteri sedang terhadap S. aureus. Sementara pada uji terhadap bakteri Vibrio alginolyticus, konsentrasi 12,5% masih menunjukkan aktivitas yang lemah. Studi yang dilakukan Maulana et al. (2021) menguji ekstrak E. spinosum yang diekstrak dengan heksan, etil asetat, dan metanol terhadap bakteri Staphylococcus mutans dan Shigella dysenteriae29. Hasil yang didapat adalah hanya ekstrak etil asetat yang mampu menginhibisi kedua spesies bakteri. Hasil TLC yang dilakukan menunjukkan bahwa ekstrak etil asetat mengandung senyawa flavonoid golongan flavon.
Senyawa yang terlibat dalam aktivitas antibakteri pada E. spinosum adalah flavonoid, triterpenoid, dan polifenol25. Senyawa golongan flavonoid dalam E. spinosum yang memiliki aktivitas antibakteri, di antaranya 2,7- naphthyridine dan 2-phenylethylamine25. Kedua golongan flavonoid tersebut menghasilkan senyawa kompleks bersama protein ekstraseluler, lalu merusak membran sel bakteri dan kemudian senyawa interseluler akan dikeluarkan, mengakibatkan kematian pada sel bakteri139. Senyawa triterpenoid meliputi cartilagineol, obtusol, dan elatol, menimbulkan reaksi bersamaan dengan porin (protein transmembran) pada membran terluar dinding sel bakteri, terjadi pembentukakn ikatan polimer sehingga mengakibatkan porin rusak. Kerusakan pada porin ini mengurangi permeabilitas pada membran sel bakteri, sehingga bakteri mengalami kekurangan nutrisi140. Sementara polifenol menghambat aktivitas enzim protease yang terdapat pada protein transport bakteri, dan merusak fungsi materi genetik141. Studi lainnya yang menyelidiki aktivitas antibakteri pada E. spinosum, salah satunya adalah studi yang dilakukan oleh Akib et al. (2019) menggunakan ekstrak metanolik E. spinosum sebagai sabun cuci tangan antiseptik25. Riset yang dilakukan Damongilala et al. (2023) menghasilkan kelompok metoksi yang terkandung pada E. spinosum, 3-(3-methoxyphenyl) propanal, menunjukkan adanya potensi antimikrobial sekaligus antioksidan26.
Kemampuan antibakteri E. spinosum masih dibilang cukup rendah jika dibandingkan dengan spesies rumput laut lain. Kemampuan E. spinosum dalam menginhibisi bakteri S. aureus pada studi yang dilakukan Safitri et al. (2018) hanya menghasilkan zona hambat yang berada di kelas antibateri “sedang” dengan konsentrasi 15%21. Jika dibandingkan dengan alga cokelat Padina australis, kemampuan ekstrak etil asetat Padina australis mampu menginhibisi bakteri S. aureus sebesar 12.25±0.60 mm dengan konsentrasi 5%142. Namun, aktivitas antibakteri E. spinosum menunjukkan hasil yang potensial jika diuji pada bakteri S. mutans dan Shigella dysenteriae pada studi yang dilakukan Maulana et al., 202129. Pada konsentrasi 0,002%, aktivitas antibakteri E. spinosum pada kedua bakteri tersebut sudah melebihi aktivitas antibakteri pada S. aureus yang terdapat pada studi Safitri et al. (2018) dengan konsentrasi 1%21. Kemungkinan aktivitas antibakteri pada E. spinosum efektif sebagai bahan pengawet pada produk kosmetik, bukan sebagai bahan aktif. Disarankan untuk melakukan uji antibakteri E. spinosum terhadap bakteri penyebab penyakit kulit lainnya, seperti Cutibacterium acnes yang menyebabkan jerawat.
Potensi E. spinosum sebagai UV Filter
Senyawa fotoprotektif adalah senyawa yang mampu melindungi sel dari kerusakan akibat paparan sinar matahari. Beberapa bahan tabir surya yang umum digunakan di industri kosmetik dapat menimbulkan dampak negatif pada kulit manusia, seperti yang dilaporkan oleh DiNardo & Downs (2018) yang menyatakan bahwa bahan aktif UV Filter dapat menimbulkan dermatitis kontak pada kulit manusia143. Bahan aktif tabir surya yang menjadi penyebab utama reaksi alergi dan dermatitis pada kulit adalah oxybenzone144–146. Selain dari segi kesehatan kulit, senyawa fotoprotektif konvensional juga mampu menimbulkan masalah yang fatal bagi ekosistem perairan. Dilaporkan pada tahun 2016, terdapat buangan produk tabir surya sebanyak 14.000 ton, dengan 10% kandungannya oxybenzone, terbuang menuju area terumbu karang tiap tahunnya147. Zat berbahaya ini mampu mempercepat laju siklus virus litik yang terdapat pada terumbu karang, dan berakibat pada keadaan stress yang mampu mematikan hewan karang148.
Senyawa fotoprotektif alami menjadi solusi untuk permasalahan kulit dan sedang banyak dilakukan pengembangan untuk menjadi produk. Senyawa fotoprotektif alami juga dapat terkandung dalam E. spinosum dan berpotensi untuk dijadikan produk kosmetik seperti sunscreen. Senyawa fotoprotektif pada alga merupakan hasil produksi dari mekanisme pertahanan alga terhadap radiasi sinar matahari untuk menghindari sel dari kerusakan oksidatif akibat dari produksi ROS dan menahan radiasi sinar matahari saat melakukan fotosintesis149. E. spinosum sebagai kelompok Rhodophyta mengandung pigmen karotenoid yang memiliki kapasitas sebagai pelindung dari sinar yang berlebihan. Flavonoid juga berpotensi menghalangi radiasi berbahaya dengan menyerap sinar matahari di spektrum ultraviolet (100–400 nm), juga memiliki sifat antioksidan dan memodulasi beberapa jalur pensinyalan pada sel150. Spektrum serapan UV dari flavonoid memiliki dua puncak absorbansi maksimum, satu antara 240 nm hingga 280 nm dan yang lainnya pada 300 nm hingga 500nm, sehingga dapat digunakan dalam formulasi sebagai penangkal radiasi UVA dan UVB151.
Senyawa fotoprotektif lain yang kemungkinan terkandung dalam E. spinosum adalah Mycosporine like Amino Acids (MAA) yang biasa ditemukan di kebanyakan spesies alga merah. Kisaran serapan ultravioletnya bervariasi dari 310 hingga 362 nm, dan dicirikan oleh koefisien kepunahan molar yang tinggi, biasanya berkisar antara 28.100 dan 50.000 M−1 cm−1152,153. MAA adalah senyawa yang mengandung asam amino pada strukturnya, yang telah terbukti memiliki aktivitas fotoprotektif154. MAA memiliki keunggulan sebagai senyawa fotoprotektif yang cukup stabil155–157. Meski begitu, MAA memiliki beberapa faktor yang dapat mengganggu fotostabilitasnya. Di antaranya adalah, radiasi ultraviolet berlebihan, pH yang terlalu asam atau basa, peningkatan suhu (>60 C), dan agen pengoksidasi158,159.
Pigmen yang terkandung pada rumput laut juga memiliki potensi sebagai bahan kosmetik karena peran besarnya dalam sistem pertahanan alga sebagai senyawa fotoprotektif. Mekanisme pertahanan pigmen adalah dengan mencegah pembentukan Reactive Oxygen Species (ROS) yang disebabkan oleh sinar Ultraviolet (UV) dan faktor abiotik lainnya160,161. Studi yang dilakukan oleh Zepeda et al. (2020) membuktikan adanya korelasi antara intensitas cahaya dan banyaknya pigmen yang dihasilkan alga, dimana semakin banyak intensitas cahaya maka semakin banyak biosintesis pigmen yang dihasilkan162. Salah satu pigmen dominan yang dapat dihasilkan oleh Rhodophyta adalah fikobiliprotein. Pigmen fikobiliprotein (PBP) merupakan kelompok senyawa protein makromolekuler yang terikat secara kovalen dengan tetrapirol rantai terbuka bernama fikobilin163. Beberapa studi telah membuktikan bahwa fikobiliprotein memiliki beberapa bioaktivitas, di antaranya adalah antioksidan, antiviral, antitumor, penambah imunitas, dan antiinflamasi164–167. Pigmen lain yang banyak ditemukan pada alga merah adalah karotenoid. Karotenoid berperan sebagai pigmen aksesori pada fase terang fotosintesis dan juga memiliki kemampuan fotoproteksi terhadap organ fotosintesis lainnya dengan cara menyerap ROS dan radikal bebas lainnya168. Karotenoid dibagi menjadi dua kelompok besar; i) Xanthophyl, mengandung oksigen sebagai kelompok fungsional, meliputi astaxanthin, zeaxanthin, dan lutein; ii) Karoten, yang hanya mengandung rantai hidrokarbon tanpa kelompok fungsional, meliputi â-karoten dan likopen181. Di bidang kosmetik, karoten berpotensi menjadi senyawa fotoprotektif dengan cara menyerap ROS dan radikal bebas akibat sinar matahari170,171. Beberapa jenis karotenoid yang dapat ditemukan pada banyak jenis tumbuhan dapat dilihat pada Gambar 5.
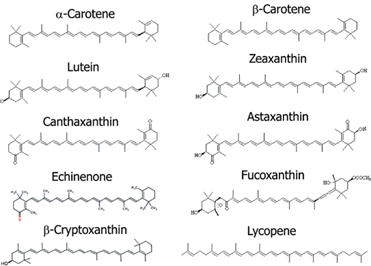
Gambar 5 Struktur kimia beberapa jenis karotenoid.
Sumber :https://www.eurofinsus.com
Studi kandungan karotenoid pada rumput laut E. spinosum sudah pernah dilakukan pada studi milik Damongilala et al. (2013), yang diambil dari perairan Arakan, Sulawesi Utara31. Pada studi tersebut, dilakukan perbandingan kandungan karoten dan aktivitas antioksidan pada sampel E. spinosum dan E. cottonii. Dari perbandingan tersebut, sampel segar E. spinosum yang diekstrak menggunakan metanol 60% mampu menghasilkan senyawa karoten yang cukup tinggi, dan aktivitas antioksidan paling tinggi di antara sampel segar dan kering E. cottonii, juga sampel kering E. spinosum. Sementara itu, studi mengenai pigmen lain dan bioaktivitasnya yang terkandung dalam E. spinosum masih belum banyak dilakukan.
Belum banyak studi mengenai kandungan fotoprotektif pada E. spinosum. Sebuah studi yang dilakukan Pakki et al. (2018) menguji kekuatan fotoprotektif ekstrak n-heksan E. spinosum dan E. cottonii dengan menghitung persentase transimisi eritema dan transmisi pigmentasi15. Kedua spesies yang diuji menunjukkan kategori proteksi total sunblock, dibuktikan dengan nilai persentase transmisi eritema <1% dan transmisi pigmentasi 3-40%, yang berarti kedua spesies termasuk dalam kategori proteksi yang paling kuat. Namun, ekstrak E. cottonii diyakini memiliki kekuatan proteksi yang lebih tinggi, karena menghasilkan nilai persentase yang lebih rendah dari ekstrak E. spinosum. Sementara itu, belum banyak ditemukan studi kekuatan fotoprotektif E. spinosum berdasarkan nilai sun protection factor (SPF).
Potensi E. spinosum sebagai anti-tyrosinase
Tyrosinase adalah enzim utama yang berperan dalam biosintesis pigmen melanin pada kulit dan rambut172,173. Melanin berfungsi untuk melindungi kulit dari radiasi sinar UV, namun paparan sinar matahari yang berlebihan dapat berdampak pada produksi melanin yang tidak biasa dan menyebabkan hiperpigmentasi seperti bintik-bintik hitam pada kulit172. Inhibisi tyrosinase dapat mencegah pembentukan tyrosinase berlebihan, sehingga digunakan dalam industri kosmetik sebagai bahan pencerah kulit172,174. Khatulistiani et al. (2020) menyelidiki lima spesies alga merah dari Binuangeun, Jawa Barat, meliputi Eucheuma sp., Eucheuma spinosum, Gelidium sp., Halymenia sp., Rhodopeltis sp.18. Uji anti tyrosinase dilakukan terhadap L-DOPA dan dihasilkan persentase anti-tyrosinase pada E. spinosum sebesar 36.71±3.81%. Hasil ini tidak lebih unggul dibanding spesies lainnya, karena persentase yang dihasilkan E. spinosum lebih rendah dari keempat spesies lainnya. Aktivitas anti-tyrosinase tertinggi terdapat pada Eucheuma sp. dengan persentase sebesar 41.36±3.80%. Meski begitu, perbedaan hasil persentase tiap spesies tidak begitu signifikan.
Potensi E. spinosum sebagai bahan pelembab kulit
Pelembab kulit menjadi salah satu produk perawatan kulit yang paling diminati konsumen. Salah satu senyawa yang dihasilkan tumbuhan yang bisa dimanfaatkan sebagai agen pelembab kulit adalah senyawa golongan alkaloid175–177. Senyawa alkaloid mengandung banyak gugus hidroksil, karboksil, dan senyawa polar yang mampu melembabkan kulit dengan cara membentuk ikatan hidrogen dengan air178. Senyawa alkaloid banyak dijumpai pada E. spinosum. Namun, studi mengenai fungsi senyawa alkaloid sebagai bahan pelembab pada E. spinosum masih sangat terbatas dan perlu dikembangkan lebih lanjut mengenai potensi iota-carrageenan dari E. spinosum sebagai agen pelembab kulit.
E. spinosum juga mampu memproduksi karaginan yang melimpah. Untuk studi potensi karaginan dari E. spinosum sebagai agen pelembab kulit pun masih terbatas dan belum banyak diketahui khasiatnya. Namun, karaginan jenis lain sudah pernah diuji kemampuannya sebagai bahan pelembab. Patel et al. (2020) menyatakan bahwa karaginan dari alga merah Chondrus crispus dapat menjadi agen penyerap air pada kulit untuk meregulasi kelembaban kulit meskipun di cuaca yang panas, serta memberikan efek menenangkan pada kulit179. Karaginan memiliki kemampuan untuk mengikat air dan pada aplikasinya dalam produk kosmetik, karaginan menahan hidrasi kulit dengan mengunci kelembaban atau menahan air agar tetap terjaga di kulit180. E. spinosum sangat berpotensi untuk menjadi penghasil karaginan pelembab kulit dan perlu dilakukan studi lanjutan mengenai fungsi karaginan E. spinosum sebagai pelembab kulit. Selain itu, pigmen xanthophyl pada alga merah juga berpotensi menjadi pelembab yang dapat meningkatkan hidrasi pada lapisan kulit stratum corneum. Perawatan dari xanthophyl yang dapat meningkatkan hidrasi kulit merupakan pengaruh dari penetrasi lutein dan zeaxhanthin ke dalam membran korneosit dan lipid interseluler181,182.
Potensi E. spinosum sebagai pencegah penuaan dini (anti-aging)
Penuaan pada kulit merupakan kondisi penurunan fungsi sel pada kulit secara progresif yang berujung kepada kematian sel183. Faktor yang mampu mempengaruhi proses penuaan pada kulit meliputi faktor internal yang merupakan pengaruh dari genetik184, dan faktor eksternal seperti paparan sinar UV dari matahari yang disebut sebagai photo-aging atau penuaan prematur185. Enzim kolagenase merupakan salah satu enzim yang mempercepat proses penuaan dengan cara menurunkan jumlah kolagen pada kulit yang berujung pada kulit terlihat kendur186. Enzim lain yang juga berperan dalam proses penuaan adalah elastase yang mendegradasi elastin pada kulit, sehingga berdampak pada kerutan kulit wajah186. Beberapa senyawa yang dapat ditemukan dalam E. spinosum yang berpotensi mampu mencegah penuaan dini di antaranya adalah polisakarida dari karaginan dan senyawa fenolik. Wang et al. (2018) menguji kemampuan polisakarida tersulfas dari Hizikia fusiforme mampu menginhibisi aktivitas kolagenase dan elastase dengan meregulasi pathway NF-κB, AP-1, dan MAPK dalam sel HDF yang diradiasi UV B187. Ryu et al. (2009) menguji kemampuan senyawa fenolik dari ekstrak etanolik alga merah Corallina pilulifera yang mampu menginhibisi enzim kolagenase, MMP 2,9, pada sel fibroblas kulit yang diradiasi sinar UV188. Karaginan dan senyawa fenolik yang dapat dihasilkan E. spinosum sangat melimpah daan dapat berpotensi dijadikan sebagai anti-aging pada produk kosmetik.
Potensi E. spinosum sebagai bahan pembentuk gel dan pengental pada produk kosmetik
Rumput laut E. spinosum banyak digunakan sebagai penghasil karaginan. Selain berpotensi sebagai bahan aktif dalam produk pelembab kulit dan anti-aging, karaginan sudah terlebih dahulu digunakan sebagai bahan pendukung suatu produk kosmetik. Di bidang kosmetik, karaginan banyak digunakan sebagai pengental produk dan agen pembentuk lapisan189(189). Karaginan terbagi atas beberapa tipe berdasarkan struktur molekulnya, beberapa di antaranya adalah kappa (κ), iota (ι) dan lambda (λ) carrageenan189. κ-carrageenan dan ι-carageenan memiliki fungsi sebagai agen pembentuk gel, sementara λ-carrageenan hanya bisa digunakan sebagai agen pengental190,191. Rumput laut E. spinosum merupakan salah satu rumput laut penghasil ι-carageenan terbanyak, ι-carageenan cenderung menghasilkan gel yang lebih elastis dengan histeresis lebih rendah dibandingkan dengan κ-carrageenan189,192. Penggunaan karaginan dalam industri kosmetik biasa diaplikasikan sebagai pengental produk dan stabilisator189,193. Fransiska et al. (2021) melakukan uji lotion pelembab dengan menambahkan karaginan193. Pengujian tersebut menghasilkan lotion yang paling optimal dengan kandungan campuran κ-carrageenan (0.2%) dan ι-carageenan (0,1%). Dengan penambahan ι-carageenan sebesar 0,1%, dihasilkan tekstur yang ringan namun tidak encer, tekstur homogen, berwarna putih, dan tidak ada perubahan bau.
Kesimpulan
Banyak studi yang menggunakan E. spinosum lokal untuk menguji potensi kandungan senyawa metabolit sekunder dan bioaktivitasnya. Rumput laut E. spinosum yang dikenal sebagai penghasil karaginan, ternyata mampu menghasilkan senyawa metabolit sekunder lain seperti flavonoid, alkaloid, terpenoid, fenol, dan sebagainya. Potensinya sebagai kosmetik juga sangat menjanjikan bagi industri kecantikan di Indonesia yang akan selalu meningkat permintaannya, sehingga menjadikan E. spinosum lokal layak untuk diuji lebih lanjut mengenai potensinya sebagai kosmetik. Dengan banyaknya uji yang dilakukan terhadap E. spinosum hasil budidaya Indonesia, diharapkan bahwa E. spinosum lokal mampu berkompetisi dengan spesies alga lainnya.
Daftar Pustaka
1. Lixandru MG. Advertising for natural beauty products: The shift in cosmetic industry. Eur Sci J. 2017;7881:6–13.
2. Matea Matic, Barbara Puh. Consumers’ Purchase Intentions Towards Natural Cosmetics. Ekon Vjesn – Rev Contemp Business, Entrep Econ Issues [Internet]. 2016;29(1):53–64. Available from: https://hrcak.srce.hr/ojs/index.php/ekonomski-vjesnik/article/view/3689
3. Ahmad SNB, Omar AB, Rose R Bin. Influence of Personal Values on Generation Z’s Purchase Intention for Natural Beauty Products. Adv Glob Bus Res. 2015;12(1):436–45.
4. Draelos ZD. Evidence-Based Procedural Dermatology. Evidence-Based Proced Dermatology. 2019;
5. Wang HMD, Chen CC, Huynh P, Chang JS. Exploring the potential of using algae in cosmetics. Bioresour Technol. 2015 May 1;184:355–62.
6.Bouanati T, Colson E, Moins S, Cabrera JC, Eeckhaut I, Raquez JM, et al. Microwave-assisted depolymerization of carrageenans from Kappaphycus alvarezii and Eucheuma spinosum: Controlled and green production of oligosaccharides from the algae biomass. Algal Res. 2020;51(August).
7. Diharmi A, Fardiaz D, Andarwulan N. Chemical and Minerals Composition of Dried Seaweed Eucheuma spinosum Collected from Indonesia Coastal Sea Regions. Int J Ocean Oceanogr. 2019;13(1):65–71.
8. Sofiana MSJ, Aritonang AB, Safitri I, Helena S, Nurdiansyah SI, Risko, et al. Proximate, Phytochemicals, Total phenolic content and antioxidant activity of ethanolic extract of Eucheuma spinosum seaweed. Syst Rev Pharm. 2020;11(8):228–32.
9. Lumbessy SY, Setyowati DNA, Mukhlis A, Lestari DP, Azhar F. Komposisi nutrisi dan kandungan pigmen fotosintesis tiga spesies alga merah (Rhodophyta sp.) hasil budidaya. J Mar Res. 2020;9(4):431–8.
10. Ridwan M, Tantu G, Zainuddin H. Analisis Kualitas Keragenan Rumput Laut Jenis Eucheuma Spinosum Pada Ekosistem Yang Berbeda Di Perairan Tomia, Kabupaten Wakatobi, Provinsi Sulawesi Tenggara. J Aquac Environ. 2019;1(2):39–45.
11. Arisandi A, Farid A, Wulandari RA, Muktisari RD. Uji Efektifitas Iodium yang Berasal dari Rumput Laut (Eucheuma spinosum) Terhadap Bakteri Escherichia coli. Juv Ilm Kelaut dan Perikan. 2023;4(4):351–8.
12. Wahid AR, Ittiqo DH, Hati MP, Safwan S, Nopianti MS, Karim SW. Physical Stability of Gel of Read Algae (Eucheuma spinosum) Extract and Evaluation of its Antioxidant effect. Res J Pharm Technol [Internet]. 2023;16(10):4729–36. Available from: http://dx.doi.org/10.52711/0974-360X.2023.00768
13. Effendi I, Prayogi MR, Mulyadi A. Antibacterial activity of Eucheuma spinosum extract against Vibrio alginolyticus and Aeromonas hydrophila. AACL Bioflux. 2023;16(2):1105–13.
14. Cut Bidara Panita Umar, Anatje J Pattipeilohy, Wa Yatmi Wali. Uji Aktivitas Antibakteri Ekstrak Etanol Rumput Laut Merah (Eucheuma Spinosum) Terhadap Pertumbuhan Bakteri Escherichia Coli Dengan Menggunakan Metode Difusi Sumuran. J Ris Rumpun Ilmu Kedokt. 2023;1(1):46–51.
15. Pakki E, Murdifin M, Wijoyo N, Sumarheni S. Study of sunscreen and antioxidant activity of combination extracts from the red algae Eucheuma cottonii and Eucheuma spinosum. Drug Invent Today. 2018;10(9):1827–30.
16. Rismayanti NLPM, Husni A. Antioxidant activity of methanolic extract of Eucheuma spinosum extracted using a microwave. IOP Conf Ser Earth Environ Sci. 2021;763(1).
17. Muawanah, Ahmad A, Natsir H. Antioxidant activity and toxicity polysaccharide extract from red algae Eucheuma spinosum and Eucheuma cottonii. Mar Chim Acta. 2016;17(2):15–23.
18. Khatulistiani TS, Noviendri D, Munifah I, Melanie S. Bioactivities of red seaweed extracts from Banten, Indonesia. IOP Conf Ser Earth Environ Sci. 2019;404(1).
19. Podungge A, Damongilala LJ, Mewengkang HW. Kandungan Antioksidan Pada Rumput Laut Eucheuma Spinosum Yang Diekstrak Dengan Metanol Dan Etanol. Media Teknol Has Perikan. 2018;6(1):1.
20. Inayah N, Masruri M. Free-Radical Scavenging Activity (FRSA) of Secondary Metabolite Extracted from Indonesian Eucheuma spinosum. Alchemy. 2021;9(1):1–6.
21. Safitri A, Srihardyastutie A, Roosdiana A, Sutrisno S. Antibacterial Activity and Phytochemical Analysis of Edible Seaweed Eucheuma spinosum Against Staphyloccocus aureus. J Pure Appl Chem Res. 2018;7(3):308–15.
22. Matanjun P, Mohamed S, Mustapha NM, Muhammad K, Ming CH. Antioxidant activities and phenolics content of eight species of seaweeds from north Borneo. J Appl Phycol [Internet]. 2008;20(4):367–73. Available from: https://doi.org/10.1007/s10811-007-9264-6
23. Balasubramaniam V, Lee JC, Noh MFM, Ahmad S, Brownlee IA, Ismail A. Alpha-amylase, antioxidant, and anti-inflammatory activities of Eucheuma denticulatum (N.L. Burman) F.S. Collins and Hervey. J Appl Phycol [Internet]. 2016;28(3):1965–74. Available from: https://doi.org/10.1007/s10811-015-0690-6
24. Sari NI, Diharmi A, Sidauruk SW, Sinurat FM. Identifikasi Komponen Bioaktif dan Aktivitas Ekstrak Rumput Laut Merah (Eucheuma spinosum). J Teknol dan Ind Pertan Indones. 2022;14(1):9–15.
25. Akib NI, Triwatami M, Putri AEP. Aktivitas Antibakteri Sabun Cuci Tangan yang Mengandung Ekstrak Metanol Rumput Laut Eucheuma spinosum. Medula. 2019;7(1):50–61.
26. Damongilala LJ, Dotulong V, Apriyanti E, Kurnia D. Antioxidant and Antibacterial Activities of the Tropical Red Alga Eucheuma spinosum: In Silico Study. Nat Prod Commun [Internet]. 2023 Jul 1;18(7):1934578X231187467. Available from: https://doi.org/10.1177/1934578X231187467
27. Putri T, Arsianti A, Subroto PAM, Lesmana E. Phytochemical analysis and antioxidant activity of marine algae Eucheuma Sp. AIP Conf Proc [Internet]. 2019 Apr 9;2092(1):30016. Available from: https://doi.org/10.1063/1.5096720
28. Zainuddin EN. Antibacterial Potential of Marine AlgaeCollected From South Sulawesi Coast AgainstHuman Pathogens. 2010;(October):115–27.
29. Maulana IT, Safira R, Aprianti I, Syafnir L, Kodir RA. Antibacterial compound from Euchema spinosum originated from Tasikmalaya West Java against pathogen bacteria with TLC-bioautography Antibacterial compound from Euchema spinosum originated from Tasikmalaya West Java against pathogen bacteria with TLC-bioau. 2022;(October 2021).
30. Abdillah AA, Alamsjah MA, Sugijanto NEN. Antioxidant properties from seaweeds Kappaphycus alvarezii, Euchema spinosum and Sargasum sp. using different solvent. IOP Conf Ser Earth Environ Sci [Internet]. 2021;679(1):12034. Available from: https://dx.doi.org/10.1088/1755-1315/679/1/012034
31. Damongilala LJ, Widjanarko SB, Zubaidah E, Runtuwene MRJ. Antioxidant Activity Against Methanol Extraction of Eucheuma cotonii and E . spinosum Collected From North Sulawesi Waters , Indonesia. 2013;17:7–14.
32. Jeane Damongilala L, Wewengkang DS, Losung F, Ekawati Tallei T. Phytochemical and Antioxidant Activities of <i>Eucheuma spinosum </i>as Natural Functional Food from North Sulawesi Waters, Indonesia. Pakistan J Biol Sci PJBS [Internet]. 2021;24(1):132–8. Available from: http://europepmc.org/abstract/MED/33683039
33. Farah Nurshahida MS, Nazikussabah Z, Subramaniam S, Wan Faizal WI, Nurul Aini MA. Physicochemical, Physical Characteristics and Antioxidant Activities of Three Edible Red Seaweeds (Kappaphycus alvarezii, Eucheuma spinosum and Eucheuma striatum) from Sabah, Malaysia. IOP Conf Ser Mater Sci Eng [Internet]. 2020;991(1):12048. Available from: https://dx.doi.org/10.1088/1757-899X/991/1/012048
34. Subroto PAM, Arsianti A, Putri T, Lesmana E. Phytochemical analysis and anticancer activity of seaweed Eucheuma Sp. against colon HCT-116 cells. AIP Conf Proc [Internet]. 2019 Apr 9;2092(1):30015. Available from: https://doi.org/10.1063/1.5096719
35. Arsianti A. Phytochemical Constituent and Antioxidant Activity Evaluation of Red Seaweed Eucheuma sp . Phytochemical Constituent and Antioxidant Activity Evaluation of Red Seaweed. 2023;2(1).
36. Sari BL, Susanti N, Sutanto S. Skrining Fitokimia dan Aktivitas Antioksidan Fraksi Etanol Alga Merah Eucheuma spinosum. Pharm Sci Res. 2015;2(2):59–68.
37. Purnamasari LS, Sutanto AH, Angelita K, Made N, Setyarini A. Relasi Konsumen dengan Produk Kecantikan serta Pengaruhnya terhadap Purchase Intention. 2022;6(4):2874–81.
38. Agustini MP, Komariah K, Mulia Z F. Analisis Interaksi Sosial Konten Marketing Dan Influencer Marketing Terhadap Minat Beli Produk Kosmetik (Survey Pada Konsumen Produk Dear Me Beauty Di Kota Sukabumi). Manag Stud Entrep J [Internet]. 2022 Jul 24;3(3 SE-Articles):1601–10. Available from: https://yrpipku.com/journal/index.php/msej/article/view/647
39. Ferdinand M, Ciptono WS. Indonesia’s Cosmetics Industry Attractiveness, Competitiveness and Critical Success Factor Analysis. J Manaj Teor dan Terap | J Theory Appl Manag. 2022;15(2):209–23.
40. Fauziyah S, Karneli O. Pengaruh Brand Trust dan Brand Equity terhadap Loyalitas Konsumen pada Produk Kosmetik Wardah (Survey Konsumen pada PT. Paragon Technology And Innovation Cabang Pekanbaru). J Online Mhs Fak Ilmu Sos dan Ilmu Polit Univ Riau. 2016;3(2):1–9.
41. Mulyani T, Ramdan AM, Samsudin A. Mengukur Loyalitas Konsumen Melalui Ekuitas Merek Pada Produk Kosmetik. J EKOBIS DEWANTARA; Vol 3 No 2 J EKOBIS DEWANTARA [Internet]. 2020; Available from: https://jurnalfe.ustjogja.ac.id/index.php/ekobis/article/view/1753
42. Chinna D, Soegoto AS, Woran D, Produk AK, Merek C, Pengaruhnya DANH, et al. Manado Analysis of Product Quality, Brand Image, and Price Influence on Consumer Loyalty on Wardah Cosmetic Products In Manado City. Jurnal EMBA Vol . 10 No . 3 April 2022 , Hal . 295-306. 2022;10(3):295–308.
43. Pangastuti J, Prastiti E. Pengaruh Kualitas Produk Dan Harga Terhadap Keputusan Pembelian Produk Kosmetik Wardah Pada Counter Wardah Di Borobudur Kediri. 2019;2:69–84.
44. Astuti AR, Sudarusman E. Pengaruh Kualitas Produk, Harga, dan Citra Merek terhadap Loyalitas Pelanggan Kosmetik Natural Nusantara di Gunungkidul. Telaah Bisnis; Vol 20, No 1 Juli 2019DO – 1035917/tb.v20i1181 [Internet]. 2021 Jan 3; Available from: https://journal.stimykpn.ac.id/index.php/tb/article/view/181
45. Hakim BN, Purwoko B. Tinjauan Pustaka Strategi Peran Strategi Pemasaran. 2019;3(3):261–78.
46. Irmayanti S, Annisa IT. Jurnal Ilmiah Manajemen dan Bisnis ( JIMBI ) Peran Mediasi Citra Merek terhadap Keputusan Pembelian Kosmetik Merek Lokal pada Wanita Urban The Role of Brand Image Mediation on Purchase Decisions for Local Brand Cosmetics in Urban Women. 2023;4(1):106–16.
47. Tilaar K, Mulyana A, Komaladewi R, Saefullah K. Uncertain Supply Chain Management Exploratory analysis of natural cosmetic products purchase intention : Evidence from Jakarta ,. 2023;11:1635–44.
48. Munerah S, Koay KY, Thambiah S. Factors influencing non-green consumers’ purchase intention: A partial least squares structural equation modelling (PLS-SEM) approach. J Clean Prod [Internet]. 2021;280:124192. Available from: https://www.sciencedirect.com/science/article/pii/S0959652620342372
49. Rubin CB, Brod B. Natural Does Not Mean Safe—The Dirt on Clean Beauty Products. JAMA Dermatology [Internet]. 2019 Dec 1;155(12):1344–5. Available from: https://doi.org/10.1001/jamadermatol.2019.2724
50. Suyanto N, Pramono S. The Effect of Green Brand Image in Building Green Brand Equity through Green Brand Trust in Cosmetics and Body Care Company The Body Shop Indonesia. Holist J Manag Res [Internet]. 2020 Nov 19;5(2 SE-). Available from: https://holistic.ubb.ac.id/index.php/holistic/article/view/1861
51. Pratiwi DD. Factors Affecting Green Purchase Behavior of Cosmetic Products Among Millennial Consumers in Indonesia. Relev J Manag Bus. 2020;3(2):126–35.
52. Mutiara A, Famiola M, Valendia IAS, Raihana J. Understanding the Antecedents of Green Cosmetics Purchase Among Indonesian Consumers. J Bus Manag Rev. 2023;4(7):510–23.
53. Pillai S. Profiling Green Consumers based on their purchase behaviour. Int J Information, Bus Manag. 2013;5(3):15.
54. Romadon Y. Pengaruh Green Marketing Terhadap Brand Image dan Struktur Keputusan Pembelian ( Survei pada Followers Account Twitter @ PertamaxIND Pengguna Bahan Bakar Ramah lingkungan Pertamax Series ). 2014;15(1).
55. Wilson N, Theodorus E, Tan PH. Analysis of Factors Influencing Green Purchase Behavior: A Case Study of The Cosmetics Industry in Indonesia. 2018 Jun 5;2:453.
56. Soerjanatamihardja KA, Fachira I. Study of Perception and Attitude Towards Green Marketing of Indonesian Cosmetics Consumers. 2017;6(1):160–72.
57. Kurnia SN, Mayangsari L. Barriers in Purchasing Green Cosmetic Products Among Indonesian Women. Malaysian J Soc Sci Humanit [Internet]. 2020 Aug 2;5(8 SE-Articles). Available from: https://msocialsciences.com/index.php/mjssh/article/view/465
58. Hoang HT, Moon J-Y, Lee Y-C. Natural Antioxidants from Plant Extracts in Skincare Cosmetics: Recent Applications, Challenges and Perspectives. Vol. 8, Cosmetics. 2021.
59. Ribeiro AS, Estanqueiro M, Oliveira MB, Sousa Lobo JM. Main Benefits and Applicability of Plant Extracts in Skin Care Products. Vol. 2, Cosmetics. 2015. p. 48–65.
60. Fowler JF, Woolery-Lloyd H, Waldorf H, Saini R. Innovations in natural ingredients and their use in skin care. J Drugs Dermatol [Internet]. 2010;9(6 Suppl):S72-81; quiz s82-3. Available from: http://europepmc.org/abstract/MED/20626172
61. Michalak M. Plant Extracts as Skin Care and Therapeutic Agents. Vol. 24, International Journal of Molecular Sciences. 2023.
62. Velázquez-Martínez V, Valles-Rosales D, Rodríguez-Uribe L, Laguna-Camacho JR, López-Calderón HD, Delgado E. Effect of Different Extraction Methods and Geographical Origins on the Total Phenolic Yield, Composition, and Antimicrobial Activity of Sugarcane Bagasse Extracts [Internet]. Vol. 9, Frontiers in Nutrition . 2022. Available from: https://www.frontiersin.org/articles/10.3389/fnut.2022.834557
63. Alara OR, Abdurahman NH, Ukaegbu CI. Extraction of phenolic compounds: A review. Curr Res Food Sci [Internet]. 2021;4:200–14. Available from: https://www.sciencedirect.com/science/article/pii/S2665927121000241
64. Kalasariya HS, Yadav VK, Yadav KK, Tirth V, Algahtani A, Islam S, et al. Seaweed-Based Molecules and Their Potential Biological Activities: An Eco-Sustainable Cosmetics. Vol. 26, Molecules. 2021.
65. Geraldes V, Pinto E. Mycosporine-Like Amino Acids (MAAs): Biology, Chemistry and Identification Features. Vol. 14, Pharmaceuticals. 2021.
66. Kageyama H, Waditee-Sirisattha R. Antioxidative, Anti-Inflammatory, and Anti-Aging Properties of Mycosporine-Like Amino Acids: Molecular and Cellular Mechanisms in the Protection of Skin-Aging. Vol. 17, Marine Drugs. 2019.
67. Figueroa FL. Mycosporine-Like Amino Acids from Marine Resource. Vol. 19, Marine Drugs. 2021.
68. López-Hortas L, Flórez-Fernández N, Torres MD, Ferreira-Anta T, Casas MP, Balboa EM, et al. Applying Seaweed Compounds in Cosmetics, Cosmeceuticals and Nutricosmetics. Vol. 19, Marine Drugs. 2021.
69. Rajauria G. In-Vitro Antioxidant Properties of Lipophilic Antioxidant Compounds from 3 Brown Seaweed. Vol. 8, Antioxidants. 2019.
70. Maharany F, Nurjanah, Suwandi R, Anwar E, Hidayat T. Kandungan Senyawa Bioaktif Rumput Laut Padina australis dan Eucheuma cottonii Sebagai Bahan Baku Krim Tabir Surya. 2017;20(1).
71. Nosa SP, Karnila R, Diharmi A. Potensi Kappa Karaginan Rumput Laut ( Eucheuma Cottonii ) Sebagai Antioksidan Dan Inhibitor Enzim α -Glukosidase The Potential Of Kappa Carrageenan Seaweed (Eucheuma Cottonii) as an Antioxidant and α -Glucosidase Enzyme Inhibitor. Berk Perikan TERUBUK. 2020;48(2):1–10.
72. Syafitri T, Hafiludin, Chandra AB. Pemanfaatan Ekstrak Rumput Laut ( Eucheuma cottonii ) Dari Perairan Sumenep Sebagai Antioksidan. J Kelaut. 2022;15(2):160–8.
73. Nurjanah, Ramli RL, Jacoeb AM, Seulalae AV. Bubur Rumput Laut Merah ( Eucheuma cottonii) dan Cokelat ( Sargassum sp .) Physicochemical and Antioxidant Characteristics of Body Scrub From Combination of. J Stand. 2021;23(3):227–40.
74. Cahyaningrum K, Husni A, Budhiyanti SA. Aktivitas Antioksidan Ekstrak Rumput Laut Cokelat. J Mar Res. 2016;36(2):137–44.
75. Sinurat E, Suryaningrum D. Aktivitas Antioksidan dan Sifat Sensori Teh Rumput Laut Sargassum sp . Berdasarkan Variasi Lama Perendaman. Inst Pertan Bogor. 2019;22:581–8.
76. Arifianti AE, Anwar E, Nurjanah. Aktivitas Penghambat Tirosinase dan Antioksidan Serbuk Rumput Laut dari Sargassum plagyphyllum Segar dan Kering. J Pengolah Has Perikan Indones. 2017;20(3):488–93.
77. Trijuliamos Manalu R, Asrida Sipayung E. Uji Aktivitas Antimikroba Ekstrak Etanol Rumput Laut Terhadap Propionibacterium Acnes Dan Aspergillus Niger Antimicrobial Activity Test of Ethanol Extract of Gracilaria Verrucosa Against Propionibacterium Acnes and Aspergillus Niger. JournalStikeskendalAcId [Internet]. 2020;9(2):101–6. Available from: http://www.journal.stikeskendal.ac.id/index.php/far/article/view/923
78. Nadiya I, Haryati S, Surilayani D, Hasanah AN, Serang K, Serang K. Karakteristik Pemanfaatan Ekstrak Rumput Laut ( Kappaphycus alvarezii ) dan Teh Hijau ( Camellia sinensis ) Sebagai Sediaan Hydrating Toner. 2023;13:157–68.
79. Yuliana. Pengaruh Perendaman Eucheuma spinosum J. Agardh Dalam Larutan Pupuk Provasoli’s Enrich Seawater Terhadap Laju Pertumbuhan Secara In Vitro. digilib.unhas.ac.id. 2013;
80. Sarita IDAADS, Subrata IM, Sumaryani NP, Rai IGA. Identifikasi Jenis Rumput Laut yang terdapat pada Ekosistem Alami Perairan Nusa Penida. J Edukasi Mat dan Sains. 2021;10(1):141–54.
81. Sunarpi, Ghazali M, Nikmatullah A, Lim PE, Phang SM. Diversity and distribution of natural populations of Eucheuma J. Agardh and Kappaphycus Doty in Nusa Tenggara Barat, Indonesia. Malaysian J Sci. 2013;32(SPEC. ISS.):127–40.
82. Noor JW. Biologi Laut, Suatu Pendekatan Ekologis. Jakarta: PT. Gramedia Pustaka Utama; 2006.
83. Hilmi Farnani Y, Cokrowati N, Farida N. Pengaruh Kedalaman Tanam Terhadap Pertumbuhan Eucheuma spinosum Pada Budidaya dengan Metode Rawai. J Kelaut. 2011;4(2):176–86.
84. Ali L, Khan AL, Al-Kharusi L, Hussain J, Al-Harrasi A. New α-Glucosidase Inhibitory Triterpenic Acid from Marine Macro Green Alga Codium dwarkense Boergs. Vol. 13, Marine Drugs. 2015. p. 4344–56.
85. Rajamani K, Balasubramanian T, Thirugnanasambandan SS. Bioassay-guided isolation of triterpene from brown alga Padina boergesenii possess anti-inflammatory and anti-angiogenic potential with kinetic inhibition of β-carotene linoleate system. LWT [Internet]. 2018;93:549–55. Available from: https://www.sciencedirect.com/science/article/pii/S0023643818303165
86. Yarkent Ç, Oncel SS. Recent Progress in Microalgal Squalene Production and Its Cosmetic Application. Biotechnol Bioprocess Eng. 2022;27(3):295–305.
87. Tran TVA, Nguyen VM, Nguyen TAN, Nguyen DHT, Tran DH, Bui TPT, et al. New triterpene sulfates from Vietnamese red alga Tricleocarpa fragilis and their α-glucosidase inhibitory activity. J Asian Nat Prod Res [Internet]. 2021 Jul 15;23(8):754–63. Available from: https://doi.org/10.1080/10286020.2020.1783658
88. Komala PTH, Husni A. Extraction Temperature Affect on Methanolic Extract Antioxidant Activity of Eucheuma spinosum. J Pengolah Has Perikan Indones. 2021;24(1):1–10.
89. Yanuarti R, Nurjanah N, Anwar E, Hidayat T. Profile of Phenolic and Antioxidants Activity from Seaweed Extract Turbinaria conoides and Eucheuma cottonii. J Pengolah Has Perikan Indones. 2017;20(2):230.
90. Aydin B. Antioxidant Properties of Some Macroalgae. 2022;31(02):2145–52.
91. De La Fuente G, Fontana M, Asnaghi V, Chiantore M, Mirata S, Salis A, et al. The Remarkable Antioxidant and Anti-Inflammatory Potential of the Extracts of the Brown Alga Cystoseira amentacea var. stricta. Vol. 19, Marine Drugs. 2021.
92. Messyasz B, Michalak I, Łęska B, Schroeder G, Górka B, Korzeniowska K, et al. Valuable natural products from marine and freshwater macroalgae obtained from supercritical fluid extracts. J Appl Phycol [Internet]. 2018;30(1):591–603. Available from: https://doi.org/10.1007/s10811-017-1257-5
93. Korzeniowska K, Łęska B, Wieczorek PP. Isolation and determination of phenolic compounds from freshwater Cladophora glomerata. Algal Res [Internet]. 2020;48:101912. Available from: https://www.sciencedirect.com/science/article/pii/S2211926420300072
94. Heffernan N, Smyth TJ, FitzGerald RJ, Soler-Vila A, Brunton N. Antioxidant activity and phenolic content of pressurised liquid and solid–liquid extracts from four Irish origin macroalgae. Int J Food Sci Technol [Internet]. 2014 Jul 1;49(7):1765–72. Available from: https://doi.org/10.1111/ijfs.12512
95. Allahgholi L, Sardari RRR, Hakvåg S, Ara KZG, Kristjansdottir T, Aasen IM, et al. Composition analysis and minimal treatments to solubilize polysaccharides from the brown seaweed Laminaria digitata for microbial growth of thermophiles. J Appl Phycol [Internet]. 2020;32(3):1933–47. Available from: https://doi.org/10.1007/s10811-020-02103-6
96. Keskinkaya HB, Deveci E, Güneş E, Okudan EŞ, Akköz C, Gümüş NE, et al. Chemical Composition, In Vitro Antimicrobial and Antioxidant Activities of Marine Macroalgae Codium fragile (Suringar) Hariot TT – Deniz Makroalgi Codium fragile (Suringar) Hariot ’in Kimyasal Bileşimi, In-Vitro Antimikrobiyal ve Antioksidan Aktiviteleri. Commagene J Biol [Internet]. 2022;6(1):94–104. Available from: https://doi.org/10.31594/commagene.1084336
97. Setyorini D, Aanisah R, Machmudah S, Winardi S, Wahyudiono, Kanda H, et al. Extraction of Phytochemical Compounds from Eucheuma cottonii and Gracilaria sp using Supercritical CO2 Followed by Subcritical Water. MATEC Web Conf. 2018;156:4–9.
98. Fabrowska J, Messyasz B, Szyling J, Walkowiak J, Łęska B. Isolation of chlorophylls and carotenoids from freshwater algae using different extraction methods. Phycol Res [Internet]. 2018 Jan 1;66(1):52–7. Available from: https://doi.org/10.1111/pre.12191
99. Nutautaitė M, Racevičiūtė-Stupelienė A, Bliznikas S, Jonuškienė I, Karosienė J, Koreivienė J, et al. Evaluation of Phenolic Compounds and Pigments in Freshwater Cladophora glomerata Biomass from Various Lithuanian Rivers as a Potential Future Raw Material for Biotechnology. Vol. 14, Water. 2022.
100. Farasat N, Sheidai M, Riahi H, Koohdar F. Study of morphological, anatomical characteristics and metabolic assay of some Ulva species (sea lettuce) in the coastal waters of the Persian Gulf, Iran. Nov Biol Reper. 2022 Dec 1;9:222–35.
101. Etemadian Y, Shabanpour B, Ghaemi V, Kordjazi M. Compare the Chlorophyll Amount in Three Brown Algae Species of the Persian Gulf by Using Three Solvents and Applying Two Formulas Compare the Chlorophyll Amount in Three Brown Algae Species of the Persian Gulf by Using Three Solvents and Applying Two Form. 2017;(November).
102. Ismail MM, El Zokm GM, Miranda Lopez JM. Nutritional, bioactive compounds content, and antioxidant activity of brown seaweeds from the Red Sea. Front Nutr. 2023;10(July).
103. Halliwell B. Food-derived antioxidants. Evaluating their importance in food and in vivo. Food Sci Agric Chem. 1999;1:67–109.
104. WRESDIYATI T, HARTANTA ANSB, ASTAWAN M. The Effect of Seaweed Eucheuma cottonii on Superoxide Dismutase (SOD) Liver of Hypercholesterolemic Rats. HAYATI J Biosci [Internet]. 2008;15(3):105–10. Available from: https://www.sciencedirect.com/science/article/pii/S1978301916302777
105. Chakraborty K, Joseph D. Antioxidant Potential and Phenolic Compounds of Brown Seaweeds Turbinaria conoides and Turbinaria ornata (Class: Phaeophyceae). J Aquat Food Prod Technol [Internet]. 2016 Nov 16;25(8):1249–65. Available from: https://doi.org/10.1080/10498850.2015.1054540
106. BLOIS MS. Antioxidant Determinations by the Use of a Stable Free Radical. Nature [Internet]. 1958;181(4617):1199–200. Available from: https://doi.org/10.1038/1811199a0
107. Rocha-Guzmán NE, González-Laredo RF, Ibarra-Pérez FJ, Nava-Berúmen CA, Gallegos-Infante J-A. Effect of pressure cooking on the antioxidant activity of extracts from three common bean (Phaseolus vulgaris L.) cultivars. Food Chem [Internet]. 2007;100(1):31–5. Available from: https://www.sciencedirect.com/science/article/pii/S0308814605007776
108. Nenadis N, Wang L-F, Tsimidou MZ, Zhang H-Y. Radical Scavenging Potential of Phenolic Compounds Encountered in O. europaea Products as Indicated by Calculation of Bond Dissociation Enthalpy and Ionization Potential Values. J Agric Food Chem [Internet]. 2005 Jan 1;53(2):295–9. Available from: https://doi.org/10.1021/jf048776x
109. Masek A, Chrzescijanska E, Latos M, Zaborski M. Influence of hydroxyl substitution on flavanone antioxidants properties. Food Chem [Internet]. 2017;215:501–7. Available from: https://www.sciencedirect.com/science/article/pii/S030881461631216X
110. Zhao F, Zhang Q, Yan Y, Jia H, Zhao X, Li X, et al. Antioxidant constituents of chrysanthemum ‘jinsidaju’ cultivated in Kaifeng. Fitoterapia [Internet]. 2019;134:39–43. Available from: https://www.sciencedirect.com/science/article/pii/S0367326X18321695
111. Puente-Garza CA, Espinosa-Leal CA, García-Lara S. Steroidal Saponin and Flavonol Content and Antioxidant Activity during Sporophyte Development of Maguey (Agave salmiana). Plant Foods Hum Nutr [Internet]. 2018;73(4):287–94. Available from: https://doi.org/10.1007/s11130-018-0684-z
112. Siddiqui T, Zia MK, Ali SS, Rehman AA, Ahsan H, Khan FH. Reactive oxygen species and anti-proteinases. Arch Physiol Biochem [Internet]. 2016 Jan 1;122(1):1–7. Available from: https://doi.org/10.3109/13813455.2015.1115525
113. Harbeoui H, Bettaieb Rebey I, Ouerghemmi I, Aidi Wannes W, Zemni H, Zoghlami N, et al. Biochemical characterization and antioxidant activity of grape (Vitis vinifera L.) seed oils from nine Tunisian varieties. J Food Biochem [Internet]. 2018 Oct 1;42(5):e12595. Available from: https://doi.org/10.1111/jfbc.12595
114. Morais T, Cotas J, Pacheco D, Pereira L. Seaweeds Compounds: An Ecosustainable Source of Cosmetic Ingredients? Vol. 8, Cosmetics. 2021.
115. Alseekh S, Perez de Souza L, Benina M, Fernie AR. The style and substance of plant flavonoid decoration; towards defining both structure and function. Phytochemistry [Internet]. 2020;174:112347. Available from: https://www.sciencedirect.com/science/article/pii/S0031942219307058
116. Tungmunnithum D, Tanaka N, Uehara A, Iwashina T. Flavonoids Profile, Taxonomic Data, History of Cosmetic Uses, Anti-Oxidant and Anti-Aging Potential of Alpinia galanga (L.) Willd. Vol. 7, Cosmetics. 2020.
117. Teo BSX, Gan RY, Abdul Aziz S, Sirirak T, Mohd Asmani MF, Yusuf E. In vitro evaluation of antioxidant and antibacterial activities of Eucheuma cottonii extract and its in vivo evaluation of the wound-healing activity in mice. J Cosmet Dermatol [Internet]. 2021 Mar 1;20(3):993–1001. Available from: https://doi.org/10.1111/jocd.13624
118. Sari M, Sofiana J, Safitri I, Helena S, Sciences N, Tanjungpura U, et al. Antioxidant and Anti-Inflammatory Activities from Ethanol Extract of Eucheuma cottonii from Lemukutan Island Waters West Kalimantan. 2021;17(4):247–53.
119. Hidayati JR, Karlina I, Ningsih DPN, Wijaya A, Bahry MS. Bioactive Compounds and Antioxidant Activity of Tropical Red Algae Gracilaria sp. from Bintan Island, Indonesia. IOP Conf Ser Earth Environ Sci [Internet]. 2023;1148(1):12004. Available from: https://dx.doi.org/10.1088/1755-1315/1148/1/012004
120. Sasadara MM V, Wirawan IGP. Effect of extraction solvent on total phenolic content, total flavonoid content, and antioxidant activity of Bulung Sangu (Gracilaria sp.) Seaweed. IOP Conf Ser Earth Environ Sci [Internet]. 2021;712(1):12005. Available from: https://dx.doi.org/10.1088/1755-1315/712/1/012005
121. Basir A, Desniar, Ristyanti WK, Tarman K. Physical treatments to induce the antibacterial and antioxidant activities of green algae Halimeda sp. from Seribu Islands, North Jakarta, Indonesia. IOP Conf Ser Earth Environ Sci [Internet]. 2020;414(1):12002. Available from: https://dx.doi.org/10.1088/1755-1315/414/1/012002
122. Kavitha K, Mahalakshmi K, Manam VK. In vitro antioxidant activity of methanolic extract of green alga Valoniopsis pachynema. World J Pharm Sci. 2015;
123. K. Kavitha KM and, Mana VK. Free radical scavenging activity of methanolic extract of green alga Valoniopsis pachynema. World J Pharm Sci. 2015;
124. Kavitha J, Palani S. Phytochemical Screening, GC-MS Analysis and Antioxidant Activity of Marine Algae Chlorococcum Humicola. WORLD J Pharm Pharm Sci. 2016;5(6):1154–67.
125. Uma R, Sivasubramanian V, Devaraj SN. Evaluation of in vitro antioxidant activities and antiproliferative activity of green microalgae , Desmococcus olivaceous and Chlorococcum humicola. 2011;2(3):82–93.
126. Moheimanian N, Firuzi O, Sohrabipour J, Jassbi AR. Assessment of Phenolic Contents and Antibacterial, Cytotoxic, and Antioxidant Activities of Five Brown Algae from the Persian Gulf. Iran J Sci Technol Trans A Sci [Internet]. 2021;45(6):1869–77. Available from: https://doi.org/10.1007/s40995-021-01187-0
127. Bhuyar P, Sundararaju S, Rahim MHA, Unpaprom Y, Maniam GP, Govindan N. Antioxidative study of polysaccharides extracted from red (Kappaphycus alvarezii), green (Kappaphycus striatus) and brown (Padina gymnospora) marine macroalgae/seaweed. SN Appl Sci [Internet]. 2021;3(4):485. Available from: https://doi.org/10.1007/s42452-021-04477-9
128. Junopia AC, Natsir H, Dali S. Effectiveness of Brown Algae (Padina australis) Extract as Antioxidant Agent. J Phys Conf Ser [Internet]. 2020;1463(1):12012. Available from: https://dx.doi.org/10.1088/1742-6596/1463/1/012012
129. Sami FJ, Soekamto NH. Antioxidant Activity , Toxicity Effect and Phytochemical Screening of Some Brown Algae Padina australis Extracts from Dutungan Island of South Sulawesi Indonesia. 2020;03(05):16–21.
130. Sanger G, Wonggo D, Montolalu LADY, Dotulong V. Pigments constituents, phenolic content and antioxidant activity of brown seaweed Sargassum sp. IOP Conf Ser Earth Environ Sci [Internet]. 2022;1033(1):12057. Available from: https://dx.doi.org/10.1088/1755-1315/1033/1/012057
131. Marraskuranto E, Nursid M, Utami S, Setyaningsih I, Tarman K. Kandungan Fitokimia , Potensi Antibakteri dan Antioksidan Hasil Ekstraksi Caulerpa racemosa dengan Pelarut Berbeda HASIL EKSTRAKSI Caulerpa racemosa DENGAN PELARUT BERBEDA Phytochemical Content , Antibacterial , and Antioxidant Potency of Caulerpa racemos. 2021;(June).
132. Astuti NA, Cokrowati N, Mukhlis A. Cultivation of Seagrapes ( Caulerpa lentillifera ) in Controlled Containers with the Addition of Different Doses of Fertilizers. 2021;2(1):1–6.
133. Lam M, Hu A, Fleming P, Lynde CW. The Impact of Acne Treatment on Skin Bacterial Microbiota: A Systematic Review. J Cutan Med Surg [Internet]. 2021 Aug 15;26(1):93–7. Available from: https://doi.org/10.1177/12034754211037994
134. Claudel J-P, Auffret N, Leccia M-T, Poli F, Corvec S, Dréno B. Staphylococcus epidermidis: A Potential New Player in the Physiopathology of Acne? Dermatology [Internet]. 2019 May 21;235(4):287–94. Available from: https://doi.org/10.1159/000499858
135. Cui SM, Li T, Wang Q, He KK, Zheng YM, Liang HY, et al. Antibacterial Effects of Schisandra chinensis Extract on Escherichia coli and its Applications in Cosmetic. Curr Microbiol [Internet]. 2020;77(5):865–74. Available from: https://doi.org/10.1007/s00284-019-01813-6
136. Wang Q, Cui S, Zhou L, He K, Song L, Liang H, et al. Effect of cosmetic chemical preservatives on resident flora isolated from healthy facial skin. J Cosmet Dermatol [Internet]. 2019 Apr 1;18(2):652–8. Available from: https://doi.org/10.1111/jocd.12822
137. Saatci C, Erdem Y, Bayramov R, Akalın H, Tascioglu N, Ozkul Y. Effect of sodium benzoate on DNA breakage, micronucleus formation and mitotic index in peripheral blood of pregnant rats and their newborns. Biotechnol Biotechnol Equip [Internet]. 2016 Nov 1;30(6):1179–83. Available from: https://doi.org/10.1080/13102818.2016.1224979
138. Matwiejczuk N, Galicka A, Brzóska MM. Review of the safety of application of cosmetic products containing parabens. J Appl Toxicol. 2020;40(1):176–210.
139. Nuria MC, Faizatun A, Sumantri. Aktivitas Antibakteri Ekstrak Etanol Daun Daun Jarak Pagar (Jatropha curcas L) Terhadap Bakteri Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, dan Salmonella typhi ATCC 1408. MEDIAGRO. 2009;5(2):26–37.
140. Murphy CM. Plant Products as Antimicrobial Agents. Clin Microbiol Rev [Internet]. 1999 Oct 1;12(4):564–82. Available from: https://doi.org/10.1128/cmr.12.4.564
141. Masduki I. Efek antibakteri ekstrak biji pinang (Areca catechu) terhadap S. aureus dan E. coli. Cermin Dunia Kedokt. 1996;109(2).
142. Klomjit A, Praiboon J, Tiengrim S, Chirapart A, Thamlikitkul V. Phytochemical composition and antibacterial activity of brown seaweed, padina australis against human pathogenic bacteria. J Fish Environ. 2021;45(1):8–22.
143. DiNardo JC, Downs CA. Dermatological and environmental toxicological impact of the sunscreen ingredient oxybenzone/benzophenone-3. J Cosmet Dermatol. 2018;17(1):15–9.
144. Warshaw EM, Buonomo M, DeKoven JG, Pratt MD, Reeder MJ, Silverberg JI, et al. Importance of Supplemental Patch Testing Beyond a Screening Series for Patients With Dermatitis: The North American Contact Dermatitis Group Experience. JAMA Dermatology [Internet]. 2021 Dec 1;157(12):1456–65. Available from: https://doi.org/10.1001/jamadermatol.2021.4314
145. Verhulst L, Goossens A. Cosmetic components causing contact urticaria: a review and update. Contact Dermatitis. 2016;75(6):333–44.
146. Heurung AR, Raju SI, Warshaw EM. Adverse Reactions to Sunscreen Agents: Epidemiology, Responsible Irritants and Allergens, Clinical Characteristics, and Management. Dermatitis [Internet]. 2014 Dec 1;25(6):289–326. Available from: https://www.liebertpub.com/doi/abs/10.1097/DER.0000000000000079
147. Downs CA, Kramarsky-Winter E, Segal R, Fauth J, Knutson S, Bronstein O, et al. Toxicopathological Effects of the Sunscreen UV Filter, Oxybenzone (Benzophenone-3), on Coral Planulae and Cultured Primary Cells and Its Environmental Contamination in Hawaii and the U.S. Virgin Islands. Arch Environ Contam Toxicol [Internet]. 2016;70(2):265–88. Available from: https://doi.org/10.1007/s00244-015-0227-7
148. Roberto D, Lucia B, Cinzia C, Donato G, Elisabetta D, Paola A, et al. Sunscreens Cause Coral Bleaching by Promoting Viral Infections. Environ Health Perspect [Internet]. 2008 Apr 1;116(4):441–7. Available from: https://doi.org/10.1289/ehp.10966
149. Amador-Castro F, Rodriguez-Martinez V, Carrillo-Nieves D. Robust natural ultraviolet filters from marine ecosystems for the formulation of environmental friendlier bio-sunscreens. Sci Total Environ. 2020;749:141576.
150. Nunes AR, Vieira ÍGP, Queiroz DB, Leal ALAB, Maia Morais S, Muniz DF, et al. Use of Flavonoids and Cinnamates, the Main Photoprotectors with Natural Origin. Adv Pharmacol Pharm Sci [Internet]. 2018 Jan 1;2018(1):5341487. Available from: https://doi.org/10.1155/2018/5341487
151. Mansuri R, Diwan A, Kumar H, Dangwal K, Yadav D, Mansuri R, et al. Potential of Natural Compounds as Sunscreen Agents. 2021;15(29):47–56.
152. Derikvand P, Llewellyn CA, Purton S. Cyanobacterial metabolites as a source of sunscreens and moisturizers: a comparison with current synthetic compounds. Eur J Phycol [Internet]. 2017 Jan 2;52(1):43–56. Available from: https://doi.org/10.1080/09670262.2016.1214882
153. Rastogi RP, Sonani RR, Madamwar D. Chapter 2 – UV Photoprotectants From Algae—Synthesis and Bio-Functionalities. In: Rastogi RP, Madamwar D, Pandey ABT-AGC, editors. Amsterdam: Elsevier; 2017. p. 17–38. Available from: https://www.sciencedirect.com/science/article/pii/B9780444637840000023
154. Singh DK, Pathak J, Pandey A, Singh V, Ahmed H, Rajneesh, et al. Chapter 15 – Ultraviolet-screening compound mycosporine-like amino acids in cyanobacteria: biosynthesis, functions, and applications. In: Singh PK, Kumar A, Singh VK, Shrivastava AKBT-A in CB, editors. Academic Press; 2020. p. 219–33. Available from: https://www.sciencedirect.com/science/article/pii/B9780128193112000152
155. Rosic NN. Mycosporine-Like Amino Acids: Making the Foundation for Organic Personalised Sunscreens. Vol. 17, Marine Drugs. 2019.
156. Shick JM, Dunlap WC. Mycosporine-like amino acids and related Gadusols: biosynthesis, accumulation, and UV-protective functions in aquatic organisms. Annu Rev Physiol. 2002;64:223–262.
157. Wada N, Sakamoto T, Matsugo S. Mycosporine-Like Amino Acids and Their Derivatives as Natural Antioxidants. Vol. 4, Antioxidants. 2015. p. 603–46.
158. Rastogi RP, Sonani RR, Madamwar D, Incharoensakdi A. Characterization and antioxidant functions of mycosporine-like amino acids in the cyanobacterium Nostoc sp. R76DM. Algal Res [Internet]. 2016;16:110–8. Available from: https://www.sciencedirect.com/science/article/pii/S2211926416300819
159. Whitehead K, Hedges JI. Photodegradation and photosensitization of mycosporine-like amino acids. J Photochem Photobiol B Biol [Internet]. 2005;80(2):115–21. Available from: https://www.sciencedirect.com/science/article/pii/S1011134405000679
160. Zubia M, Freile-Pelegrín Y, Robledo D. Photosynthesis, pigment composition and antioxidant defences in the red alga Gracilariopsis tenuifrons (Gracilariales, Rhodophyta) under environmental stress. J Appl Phycol [Internet]. 2014;26(5):2001–10. Available from: https://doi.org/10.1007/s10811-014-0325-3
161. Álvarez-Gómez F, Korbee N, Figueroa FL. Effects of UV Radiation on Photosynthesis, Antioxidant Capacity and the Accumulation of Bioactive Compounds in Gracilariopsis longissima, Hydropuntia cornea and Halopithys incurva (Rhodophyta). J Phycol [Internet]. 2019 Dec 1;55(6):1258–73. Available from: https://doi.org/10.1111/jpy.12899
162. Zepeda E, Freile-Pelegrín Y, Robledo D. Nutraceutical assessment of Solieria filiformis and Gracilaria cornea (Rhodophyta) under light quality modulation in culture. J Appl Phycol [Internet]. 2020;32(4):2363–73. Available from: https://doi.org/10.1007/s10811-019-02023-0
163. Apt KE, Collier JL, Grossman AR. Evolution of the Phycobiliproteins. J Mol Biol [Internet]. 1995;248(1):79–96. Available from: https://www.sciencedirect.com/science/article/pii/S0022283685702033
164. Pan-utai W, Iamtham S. Extraction, purification and antioxidant activity of phycobiliprotein from Arthrospira platensis. Process Biochem [Internet]. 2019;82:189–98. Available from: https://www.sciencedirect.com/science/article/pii/S1359511319302612
165. Braune S, Krüger-Genge A, Kammerer S, Jung F, Küpper J-H. Phycocyanin from Arthrospira platensis as Potential Anti-Cancer Drug: Review of In Vitro and In Vivo Studies. Vol. 11, Life. 2021.
166. Ismail GA, El-Sheekh MM, Samy RM, Gheda SF. Antimicrobial, Antioxidant, and Antiviral Activities of Biosynthesized Silver Nanoparticles by Phycobiliprotein Crude Extract of the Cyanobacteria Spirulina platensis and Nostoc linckia. Bionanoscience [Internet]. 2021;11(2):355–70. Available from: https://doi.org/10.1007/s12668-021-00828-3
167. Qiang X, Wang L, Niu J, Gong X, Wang G. Phycobiliprotein as fluorescent probe and photosensitizer: A systematic review. Int J Biol Macromol [Internet]. 2021;193:1910–7. Available from: https://www.sciencedirect.com/science/article/pii/S014181302102420X
168. Murthy KNC, Vanitha A, Rajesha J, Swamy MM, Sowmya PR, Ravishankar GA. In vivo antioxidant activity of carotenoids from Dunaliella salina — a green microalga. Life Sci [Internet]. 2005;76(12):1381–90. Available from: https://www.sciencedirect.com/science/article/pii/S0024320504009099
169. Saini RK, Keum Y-S. Carotenoid extraction methods: A review of recent developments. Food Chem [Internet]. 2018;240:90–103. Available from: https://www.sciencedirect.com/science/article/pii/S0308814617312529
170. Stahl W, Heinrich U, Jungmann H, Sies H, Tronnier H. Carotenoids and carotenoids plus vitamin E protect against ultraviolet light–induced erythema in humans123. Am J Clin Nutr [Internet]. 2000;71(3):795–8. Available from: https://www.sciencedirect.com/science/article/pii/S0002916523070739
171. Baswan SM, Klosner AE, Weir C, Salter-Venzon D, Gellenbeck KW, Leverett J, et al. Role of ingestible carotenoids in skin protection: A review of clinical evidence. Photodermatol Photoimmunol Photomed [Internet]. 2021 Nov 1;37(6):490–504. Available from: https://doi.org/10.1111/phpp.12690
172. Minsat L, Peyrot C, Brunissen F, Renault J-H, Allais F. Synthesis of Biobased Phloretin Analogues: An Access to Antioxidant and Anti-Tyrosinase Compounds for Cosmetic Applications. Vol. 10, Antioxidants. 2021.
173. Li J, Feng L, Liu L, Wang F, Ouyang L, Zhang L, et al. Recent advances in the design and discovery of synthetic tyrosinase inhibitors. Eur J Med Chem [Internet]. 2021;224:113744. Available from: https://www.sciencedirect.com/science/article/pii/S0223523421005936
174. Lall N, Kishore N. Are plants used for skin care in South Africa fully explored? J Ethnopharmacol [Internet]. 2014;153(1):61–84. Available from: https://www.sciencedirect.com/science/article/pii/S0378874114001342
175. Wang Q, Lu J, Jin Z, Chen K, Zhao M, Sun Y. Study on the Structure and Skin Moisturizing Properties of Hyaluronic Acid Viscose Fiber Seamless Knitted Fabric for Autumn and Winter. Vol. 15, Materials. 2022.
176. Lourith N, Pungprom S, Kanlayavattanakul M. Formulation and efficacy evaluation of the safe and efficient moisturizing snow mushroom hand sanitizer. J Cosmet Dermatol [Internet]. 2021 Feb 1;20(2):554–60. Available from: https://doi.org/10.1111/jocd.13543
177. Marseglia A, Licari A, Agostinis F, Barcella A, Bonamonte D, Puviani M, et al. Local rhamnosoft, ceramides and L-isoleucine in atopic eczema: a randomized, placebo controlled trial. Pediatr Allergy Immunol [Internet]. 2014 May 1;25(3):271–5. Available from: https://doi.org/10.1111/pai.12185
178. Lu Y, Zhang W, Zhou L, Xiong Y, Liu Q, Shi X, et al. The moisturizing effect of Capparis spinosa fruit extract targeting filaggrin synthesis and degradation. J Cosmet Dermatol [Internet]. 2023 Feb 1;22(2):651–60. Available from: https://doi.org/10.1111/jocd.15461
179. Patel NB, Tailor V, Rabadi M, Jain A. Role of marine macroalgae in Skin hydration and photoprotection benefits : A review Role of marine macroalgae in Skin hydration and photoprotection benefits : A review. 2020;(September).
180. Shafie MH, Kamal ML, Zulkiflee FF, Hasan S, Uyup NH, Abdullah S, et al. Application of Carrageenan extract from red seaweed (Rhodophyta) in cosmetic products: A review. J Indian Chem Soc [Internet]. 2022;99(9):100613. Available from: https://www.sciencedirect.com/science/article/pii/S0019452222002758
181. Fitzpatrick RE, Rostan EF. Double-Blind, Half-Face Study Comparing Topical Vitamin C and Vehicle for Rejuvenation of Photodamage. Dermatologic Surg [Internet]. 2002;28(3). Available from: https://journals.lww.com/dermatologicsurgery/fulltext/2002/03000/double_blind,_half_face_study_comparing_topical.7.aspx
182. Morganti P, Bruno C, Guarneri F, Cardillo A, Del Ciotto P, Valenzano F. Role of topical and nutritional supplement to modify the oxidative stress*. Int J Cosmet Sci [Internet]. 2002 Dec 1;24(6):331–9. Available from: https://doi.org/10.1046/j.1467-2494.2002.00159.x
183. Cao L, Lee SG, Lim KT, Kim H-R. Potential Anti-Aging Substances Derived from Seaweeds. Vol. 18, Marine Drugs. 2020.
184. Makrantonaki E, Adjaye J, Herwig R, Brink TC, Groth D, Hultschig C, et al. Age-specific hormonal decline is accompanied by transcriptional changes in human sebocytes in vitro. Aging Cell [Internet]. 2006 Aug 1;5(4):331–44. Available from: https://doi.org/10.1111/j.1474-9726.2006.00223.x
185. Pientaweeratch S, Panapisal V, Tansirikongkol A. Antioxidant, anti-collagenase and anti-elastase activities of Phyllanthus emblica, Manilkara zapota and silymarin: an in vitro comparative study for anti-aging applications. Pharm Biol [Internet]. 2016 Sep 1;54(9):1865–72. Available from: https://doi.org/10.3109/13880209.2015.1133658
186. Jesumani V, Du H, Aslam M, Pei P, Huang N. Potential Use of Seaweed Bioactive Compounds in Skincare—A Review. Vol. 17, Marine Drugs. 2019.
187. Wang L, Lee W, Oh JY, Cui YR, Ryu B, Jeon Y-J. Protective Effect of Sulfated Polysaccharides from Celluclast-Assisted Extract of Hizikia fusiforme Against Ultraviolet B-Induced Skin Damage by Regulating NF-κB, AP-1, and MAPKs Signaling Pathways In Vitro in Human Dermal Fibroblasts. Vol. 16, Marine Drugs. 2018.
188. Ryu B, Qian Z-J, Kim M-M, Nam KW, Kim S-K. Anti-photoaging activity and inhibition of matrix metalloproteinase (MMP) by marine red alga, Corallina pilulifera methanol extract. Radiat Phys Chem [Internet]. 2009;78(2):98–105. Available from: https://www.sciencedirect.com/science/article/pii/S0969806X08002260
189. Tarman K, Sadi U, Santoso J, Hardjito L. Carrageenan and its Enzymatic Extraction. In: Encyclopedia of Marine Biotechnology [Internet]. 2020. p. 147–59. Available from: https://doi.org/10.1002/9781119143802.ch7
190. Campo VL, Kawano DF, Silva DB da, Carvalho I. Carrageenans: Biological properties, chemical modifications and structural analysis – A review. Carbohydr Polym [Internet]. 2009;77(2):167–80. Available from: https://www.sciencedirect.com/science/article/pii/S0144861709000459
191. Mehta AS, Mody KH, Iyer A, Ghosh PK. Preparation of semi-refined κ -c arrageenan : Recycling of alkali solution and recovery of alkali from spent liquor. 2008;15(January):45–52.
192. Zia KM, Tabasum S, Nasif M, Sultan N, Aslam N, Noreen A, et al. A review on synthesis, properties and applications of natural polymer based carrageenan blends and composites. Int J Biol Macromol [Internet]. 2017;96:282–301. Available from: https://www.sciencedirect.com/science/article/pii/S0141813016313873
193. Fransiska D, Darmawan M, Sinurat E, Sedayu BB, Wardhana YW, Herdiana Y, et al. Characteristics of Oil in Water (o/w) Type Lotions Incorporated with Kappa/Iota Carrageenan. IOP Conf Ser Earth Environ Sci [Internet]. 2021;715(1):12050. Available from: https://dx.doi.org/10.1088/1755-1315/715/1/012050
cara mengutip artikel
https://jurnal.unpad.ac.id/farmasetika/rt/captureCite/56043/0
 Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3
Majalah Farmasetika Jurnal Ilmiah Nasional Terakreditasi SINTA 3